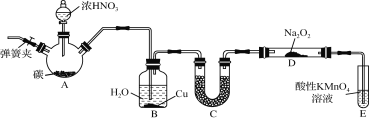
题目内容
【题目】已知某可逆反应:mA(g)+nB(g) ![]() r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是( )
r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是( )
A.T1>T2 , p1>p2 , m+n>r,正反应吸热
B.T1<T2 , p1<p2 , m+n<r,正反应吸热
C.T1>T2 , p1>p2 , m+n<r,正反应放热
D.T1<T2 , p1<p2 , m+n>r,正反应放热
【答案】B
【解析】根据“先拐先平,温高压大”,当压强相同时,温度为T2的先达到平衡,说明温度是T2大于T1。但温度越高,反应物的含量越低,所以正反应是吸热反应。当温度相同时,压强为P2的先达到平衡,说明P2大于P1 , 压强越大,反应物的含量越高,所以正反应是体积增大的反应,即m+n<r;选B。
第一步:温度、压强大小判断
温度越高,反应越快,越先平衡:由P2相同时,T2先于T1平衡,说明温度是T2大于T1
压强越大,气体体积减小,则浓度越大,反应越快,越先平衡,由T2相同时,压强为P2的先达到平衡,说明P2大于P1 ,
第二步:平衡移动方向判断
由P2相同时,T2大于T1 , 【平衡向减小温度(吸热)的方向移动】,现随温度越高,反应物B%减小,所以正反应是吸热反应。
由T2相同时,压强P2大于P1 , 【平衡向减小压强(气体物质系数总和小)的方向移动】,现随压强越高,反应物B%增大,所以m+n<r

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:
元素 | 有关信息 |
A | 元素主要化合价为-2,原子半径为0.074nm |
B | 所在主族序数与所在周期序数之差为4 ,形成的单质是黄绿色有毒气体 |
C | 原子半径为 |
D | 最高价氧化物的水化物能按 |
E | 原子半径为 |
(1)写出C元素在周期表中的位置_________________,写出D元素最高价氧化物的水化物电子式________________。
(2)写出A与C元素气态氢化物的稳定性由大到小的顺序是______________![]() 填化学式
填化学式![]() 。
。
(3)写出B与C元素最高价氧化物的水化物酸性由弱到强的顺序是_________![]() 填化学式
填化学式![]() 。
。
(4)写出D的单质在氧气中燃烧生成产物为淡黄色固体,该氧化物含有的化学键类型是________________。
(5)砷![]() 与E同一主族,As原子比E原子多两个电子层,则As的原子序数为_______,其氢化物的化学式为___________。
与E同一主族,As原子比E原子多两个电子层,则As的原子序数为_______,其氢化物的化学式为___________。