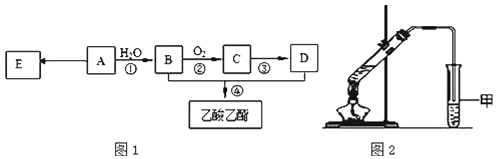
题目内容
【题目】下列有关金属的工业制法中,正确的是![]()
![]()
A. 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
B. 制铁:以铁矿石为原料,用焦炭和空气反应生成CO在高温下还原铁矿石中的铁
C. 制镁:用海水为原料,经一系列过程制得氧化镁固体,电解熔融的氧化镁得镁
D. 制钛:用金属钠置换![]() 溶液中的钛
溶液中的钛
【答案】B
【解析】根据金属冶炼的方法结合金属活动性顺序表分析解答。
A.工业制钠是电解熔融NaCl:2NaCl![]() 2Na+Cl2↑,而电解纯净的NaCl溶液:2NaCl+2H2O
2Na+Cl2↑,而电解纯净的NaCl溶液:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,得不到钠,故A错误;B.工业制铁是用CO还原铁矿石:3CO+Fe2O3
2NaOH+H2↑+Cl2↑,得不到钠,故A错误;B.工业制铁是用CO还原铁矿石:3CO+Fe2O3![]() 2Fe+3CO2,故B正确;C.氧化镁熔点高,工业制镁是电解熔融氯化镁:MgCl2
2Fe+3CO2,故B正确;C.氧化镁熔点高,工业制镁是电解熔融氯化镁:MgCl2![]() Mg+Cl2↑,故C错误;D.钠能与水反应,工业制钛:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛,TiCl4+2Mg
Mg+Cl2↑,故C错误;D.钠能与水反应,工业制钛:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛,TiCl4+2Mg![]() Ti+2MgCl2,故D错误;故选B。
Ti+2MgCl2,故D错误;故选B。

 阅读快车系列答案
阅读快车系列答案【题目】NO2为红棕色气体,可在火箭燃料中作氧化剂。回答下列问题:
(1)火箭用N2H4和NO2作燃料,产物绿色无污染,该反应的化学方程式为____________。
(2)为探究NO2和铁粉反应的产物,某小组按下图所示装置进行实验。
已知:①二者反应可能的还原产物为N2或NO
②沸点:NO2(21℃),NO(-152℃)
③酸性KMnO4溶液能氧化NO生成NO3-
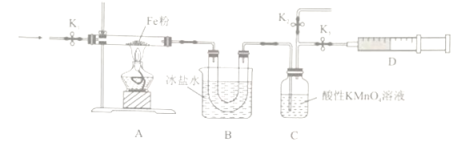
①按上图所示组装完实验仪器后,下一步操作为______________________________。
②实验前需利用气体X将装置的空气排净,气体X可以为_______(填标号)。
A.Ar B.H2 C.CO D.NO2
③排净空气后,后续实验的最佳操作顺序是___c、b(填标号)。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.打开K1和K2,关闭K3,缓缓通入气体X
d.打开K1和K3,关闭K2,缓缓通入NO2 e.关闭K1,停止通入NO2
④装置B的作用是__________________________________。
(3)分析NO2和铁粉反应的产物
①实验过程中A、C装置的物质均无明显颜色变化,D收集到无色气体。由此可推知气体产物为____________________________。
②取少量固体产物于试管,先加入盐酸充分溶解,再加入KSCN溶液,溶液若无血红色,则产物不含三价铁。该方案是否可行并说明理由:_______________________________。
③实验得到的相关数据如下表:
玻璃管质量/g | Fe质量/g | 反应后(玻璃管+固体)/g |
m | 1.12 | m+1.52 |
综合实验现象和计算可知,固体生成物一定有______(填“FeO”Fe2O3”或“Fe3O4”);反应的方程式为______