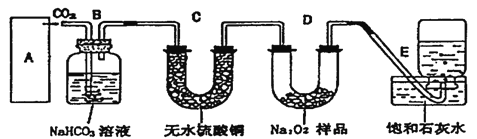
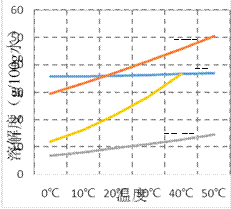
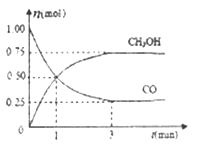
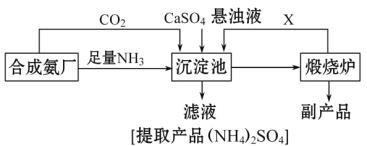
题目内容
【题目】短周期元素甲、乙、丙、丁、戊在元素周期表中的相对位置如图所示。下列说法正确的是
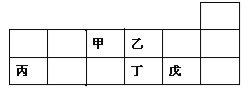
A. 原子半径的大小顺序为:甲>乙>丙>戊
B. 氢化物的稳定性:乙>丁;氢化物的沸点:丁>乙
C. 元素甲与元素丙的最高正化合价之和的数值等于8
D. 元素戊的氧化物对应的水化物的酸性一定比丁的强
【答案】C
【解析】试题分析: 根据短周期非金属元素甲~戊在元素周期表中的相对位置可知,甲、乙是第二周期元素,丙、丁、戊是第三周期元素,这几种元素分别是N、O、Al、S、Cl。A.电子层数越多,原子半径越大,而同一周期元素,原子半径随着原子序数增大而减小,所以原子半径丙>戊>甲>乙,A项错误;B.乙、丁是同族元素,非金属性乙>丁,则氢化物的稳定性乙>丁,乙的氢化物是水,丁的氢化物是H2S,水中含有氢键,则氢化物的沸点:乙>丁,B项错误;C.元素甲与元素丙分别是N、Al,N的最高正化合价是+5,而Al的最高正化合价为+3,两者之和的数值等于8,C项正确;D.元素戊的氧化物对应的水化物是HClO,HClO是弱酸,丁的氧化物对应的水化物是H2SO4,硫酸是强酸,D项错误;答案选C。

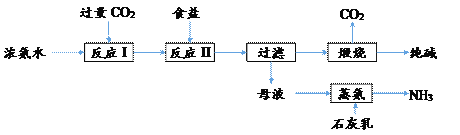
【题目】软锰矿(主要成分为MnO2)可用于制备锰及其化合物,现代冶炼金属锰的工艺流程如下图所示,步骤中杂质离子逐一沉淀。

下表为t℃时,有关物质的Ksp
物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
Ksp | 4.0×10-38 | 2.2 | 5.5 | 1.9 | 6.3 | 9.1 | 2.5 | 2.2 |
软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4===12MnSO4+6CO2↑+18H2O
(1)写出一种能提高还原浸出速率的措施:_________________________
(2)调节pH 步骤中生成的沉淀为________。加入MnF2的主要目的是除去__________ (填“Ca2+”、“Fe3+”或“Cu2+”)
(3)等浓度的(NH4)2S与(N4)2SO4 溶液中,NH4+的浓度大小为:前者________后者(填“>”、“< ” “=” )。
(4)由MnSO4制取MnCO3往MnSO4溶液中加入(NH4)2CO3溶液生成MnCO3,同时还会产生Mn(OH)2,可能的原因有:MnCO3(s)+2OH-(aq)![]() Mn(OH)2(s)+CO
Mn(OH)2(s)+CO![]() (aq),t℃时,计算该反应的平衡常数K=_________________(保留一位小数)。
(aq),t℃时,计算该反应的平衡常数K=_________________(保留一位小数)。