题目内容
【题目】某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)22SO4的工艺流程:
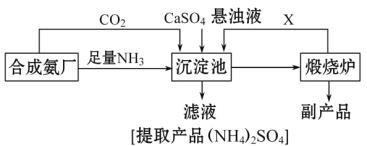
请回答以下问题:
(1)工业合成氨反应的条件是_____________________。沉淀池中发生的主要反应方程式是________________________。该反应能够发生的原因是__________________________。
(2)提纯滤液以获得(NH4)2SO4晶体,必要的操作步骤是:__________(填序号)。
A.萃取 B.蒸发浓缩 C.冷却结晶 D.蒸馏
(3)上述生产流程中,有关NH3的作用及说明正确的是:__________(填序号)。
A.提供制备所需的氮元素
B.增大CO32-的浓度促进反应发生
C.作反应的催化剂
D.生产1 mol (NH4)2SO4,至少消耗2 mol NH3
(4)该生产过程中的副产品是_______________,从绿色化学和资源综合利用的角度说明上述流程的主要优点是______________.缺点是_____________。
【答案】高温、高压、催化剂 2NH3+CO2+ CaSO4+H2O=CaCO3+(NH4)2SO4 碳酸钙的溶解度小于硫酸钙的溶解度 BC ABD 氧化钙 产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生 硫酸钙的溶解度较小,此生产过程的反应速率较慢,原料的转化率较低,故生产效率比较低
【解析】
(1)合成氨反应条件需要高温、高压、催化剂;根据流程可以判断出NH3、CO2和 CaSO4反应的产物;利用沉淀溶解平衡原理分析反应发生的原因;
(2)获得晶体,应先浓缩溶液,再进行冷却结晶,从而得到晶体;
(3)根据工艺流程图可以判断NH3的作用;
(4)在煅烧炉中煅烧CaCO3可得到氧化钙和二氧化碳,据此判断;优点从流程中可以找到二氧化碳的循环利用,得到的产品和副产品都是有用的物质角度分析;缺点从硫酸钙溶解度较小,浓度小,反应速率慢,转化率低角度进行分析。
(1)工业合成氨反应的条件是高温、高压、催化剂;将NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生反应为:2NH3+CO2+ CaSO4+H2O=CaCO3+(NH4)2SO4;该反应能够发生的原因是碳酸钙的溶解度小于硫酸钙的溶解度,反应向溶解度较小的方向进行;综上所述,本题答案是:高温高压催化剂,2NH3+CO2+ CaSO4+H2O=CaCO3↓+(NH4)2SO4;碳酸钙的溶解度小于硫酸钙的溶解度。
(2)从溶液中获取晶体应采取蒸发浓缩、冷却结晶等操作,所以必须操作步骤是BC;因此,本题正确答案是:BC。
(3)A.氨气被转化为硫酸铵晶体,提供了所需要的氮元素,故A正确;
B.氨气可以与CO2反应,促进CO2转化为CO32-,而增大CO32-的浓度,故B正确;
C.氨气参与反应,其物质的量减少,不做催化剂,故C错误;
D.根据化学方程式可以知道,生产1mol(NH4)2SO4,至少消耗2molNH3,故D正确;
综上所述,本题选ABD。
(4)反应发生后,生成碳酸钙和硫酸铵;分离出碳酸钙后,再进行高温煅烧,碳酸钙分解为氧化钙和二氧化碳,所以该生产过程中的副产品是氧化钙;该流程中,产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生;缺点是由于硫酸钙的溶解度较小,此生产过程的反应速率较慢,原料的转化率较低,故生产效率比较低。综上所述,本题答案是:氧化钙;产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生;硫酸钙的溶解度较小,此生产过程的反应速率较慢,原料的转化率较低,故生产效率比较低。

 阅读快车系列答案
阅读快车系列答案