题目内容
【题目】已知:[CoCl4]2-(蓝色)与[Co(H2O)6]2+(粉红色)之间存在如下平衡:[CoCl4]2-+6H2O [Co(H2O)6]2++4Cl- △H<0。现有呈现紫色的氯化钴溶液。
(1)甲同学向上述溶液中通入HC1,发现溶液变为___色;
(2)乙同学向上述溶液中加水,平衡___(填“向右”、“向左”或“不”)移动。为使平衡保持该移动方向,还可采取的措施有____(写一种)。
【答案】蓝 向右 降温
【解析】
(1)向溶液中通入HCl,增大了Cl-的浓度,使平衡逆向移动,溶液变为蓝色;
(2)向溶液中加水,平衡正向移动,溶液逐渐变为粉红色;由于△H<0,可知降低温度能使平衡正向移动。

 寒假学与练系列答案
寒假学与练系列答案【题目】Ⅰ.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | 50 |
E | 2 | 薄片 | 45 | 25 |
F | 2 | 粉末 | 15 | 5 |
(1)写出实验中发生反应的离子方程式:___________,该反应是_____反应(填“放热”或“吸热”);
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花____ s。
(3)对比结果B与F,解释结果F那么快的原因:________
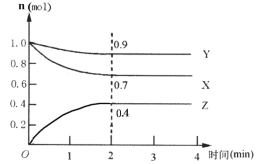
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体)。
(1)该反应的的化学方程式为_______;
(2)反应开始至2分钟时,X的平均反应速率为______;
(3)能说明该反应已达到平衡状态的是______;
a.每消耗3molX,同时消耗1molY
b.容器内压强保持不变
c.Z的浓度不再变化
d.容器内混合气体的密度保持不变
(4)由下图求得平衡时Y的转化率为_____。