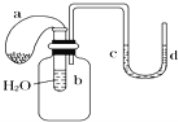
题目内容
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的有关知识,同答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是 . (填序号)
a.纯铁硬度比生铁高 b.纯铁耐腐蚀性强,不易生锈
c.不锈钢是铁合金,只含金属元素 d.铁在一定条件下,可与水蒸气反应
e.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1molL﹣1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为 , 所形成该分散系的微粒粒度范围是 .
(3)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路极.请写出FeCl3溶液与铜反应的离子方程式
(4)高铁酸钠(Na2FeO4)是一种新型净水剂.高铁酸钠在水中可以发生如下反应:4FeO42﹣+10H2O=4Fe(OH)3+8OH﹣+3O2 . 由此看来,高铁酸钠能够杀菌消毒是因为它具有性,而能够除去水中悬浮物是因为
【答案】
(1)bde
(2)Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+;1﹣100nm
Fe(OH)3(胶体)+3H+;1﹣100nm
(3)2Fe3++Cu═2Fe2++Cu2+
(4)氧化;水解生成的Fe(OH)3胶体能吸附水中的悬浮物
【解析】解:(1)a.合金的硬度比各成分金属的大,故A错误;b.纯铁不能形成原电池,生铁含碳量高,容易形成原电池,腐蚀速率快,故B正确;
c.不锈钢含有的金元素有铁、镍、钼、钛、铌、铜、氮等,故错误;
d.铁与水蒸气在高温下反应生成四氧化三铁和氢气,故D正确;
e.浓硫酸具有强的氧化性,冷的浓硫酸与铁发生钝化反应,故E正确;
故选:bde;(2)氢氧化铁胶体制备的离子方程式为:Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+ , 氢氧化铁胶体的微粒直径范围是1﹣100nm,
Fe(OH)3(胶体)+3H+ , 氢氧化铁胶体的微粒直径范围是1﹣100nm,
所以答案是:Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+;1﹣100nm;(3)FeC13溶液与铜反应生成氯化亚铁了氯化铜,离子方程式:2Fe3++Cu═2Fe2++Cu2+;
Fe(OH)3(胶体)+3H+;1﹣100nm;(3)FeC13溶液与铜反应生成氯化亚铁了氯化铜,离子方程式:2Fe3++Cu═2Fe2++Cu2+;
所以答案是:2Fe3++Cu═2Fe2++Cu2+;(4)高铁酸钠具有氧化性物质能够杀菌消毒,生成的三价铁离子水解生成氢氧化铁胶体,氢氧化铁胶体具有吸附性,可以吸附水中的悬浮杂质;
所以答案是:氧化性;水解生成的 Fe(OH)3胶体能吸附水中的悬浮物.

 阅读快车系列答案
阅读快车系列答案【题目】下列对应关系正确的是
选项 | 现象或事实 | 解释或结论 |
A | CuSO4+H2S===CuS↓+H2SO4 | 该反应不能发生,因为酸性H2SO4>H2S |
B | 向氯化钙溶液中通入CO2,未出现白色沉淀 | CO2过量,生成碳酸氢钙 |
C | 用激光笔照射向硅酸纳溶液中滴入几滴稀盐酸,有丁达尔现象 | 生成了硅酸胶体 |
D | 向某溶液中先滴加氯水再滴加KSCN,溶液变红 | 溶液中含有Fe2+ |
A. A B. B C. C D. D