题目内容
9.常温下,相同pH的硫酸溶液和硫酸铝溶液中由水电离出的c(H+)分别是1.0×10-amol/L和1.0×10-bmol/L,水的电离度分别是α1和α2,则下列关系正确的是( )| A. | α1=α2 | B. | a+b=14 | C. | a<b | D. | a<7,b>7 |
分析 常温下,水的离子积为kw=10-14,在硫酸溶液中,硫酸对水的电离有抑制作用,故溶液中的氢离子几乎全部来自于硫酸的电离,而氢氧根全部来自于水的电离,而水电离出的氢氧根的浓度和氢离子浓度相等,故硫酸溶液中氢氧根的浓度为c(OH-)=1.0×10-amol/L;
在硫酸铝溶液中,铝离子的水解对水的电离有促进作用,且由于硫酸铝为正盐,故溶液中氢离子和氢氧根均全部来自于水的电离,但由于氢氧根被水解的铝离子结合,故溶液中的氢离子1.0×10-bmol/L是水电离出的全部,据此分析.
解答 解:A、硫酸对水的电离有抑制作用,而硫酸铝是强酸弱碱盐,在溶液中能水解,对水的电离有促进作用,故两溶液中水的电离程度不同,且α1<α2,故A错误;
B、设两溶液的pH均为x.即两溶液中的c(H+)均为10-xmol/L.在硫酸溶液中,溶液中的氢离子几乎全部来自于硫酸的电离,而氢氧根全部来自于水的电离,而水电离出的氢氧根的浓度和氢离子浓度相等,故硫酸溶液中氢氧根的浓度为c(OH-)=1.0×10-amol/L,根据水的离子积可有:10-xmol/L×1.0×10-amol/L=10-14(mol/L)2 ①;
在硫酸铝溶液中,铝离子的水解对水的电离有促进作用,且由于硫酸铝为正盐,故溶液中氢离子和氢氧根均全部来自于水的电离,但由于氢氧根被水解的铝离子结合,故溶液中的氢离子1.0×10-bmol/L是水电离出的全部,故有10-xmol/L=1.0×10-bmol/L ②,将①②联立可知:10-bmol/L×1.0×10-amol/L=10-14(mol/L)2,故有a+b=14,故B正确;
C、硫酸对水的电离有抑制作用,而硫酸铝是强酸弱碱盐,在溶液中能水解,对水的电离有促进作用,故两溶液中水的电离程度α1<α2,即两溶液中水电离出的氢离子浓度1.0×10-amol/L<1.0×10-bmol/L,故a>b,故C错误;
D、硫酸对水的电离有抑制作用,故硫酸溶液中水电离出的氢离子浓度1.0×10-amol/L<10-7mol/L,故a>7;而硫酸铝是强酸弱碱盐,在溶液中能水解,对水的电离有促进作用,故硫酸铝溶液中水电离出的氢离子浓度1.0×10-bmol/L>10-7mol/L,故b<7,故D错误.
故选B.
点评 本题考查了酸和能水解的盐溶液中的pH的有关计算,难度较大,应注意公式的运用和酸对水的电离的抑制以及盐对水的电离的促进.

 优百分课时互动系列答案
优百分课时互动系列答案| A. | 两种溶液中的c(Na+)相等 | |
| B. | 分别加水稀释到100 mL时,两种溶液的pH依然相等 | |
| C. | 两溶液中由水电离出的c(OH-)之比为10-9/10-5 | |
| D. | 分别与同浓度的盐酸反应,pH=7时消耗的盐酸体积相等 |
| A. | 200ml 2mol/L Mg Cl2溶液 | B. | 1000 ml 2.5 mol/LNaCl | ||
| C. | 300 ml 5 mol/L K Cl 溶液 | D. | 250 ml 1 mol/L AlCl3 |
| A. | 分子组成符合CnH2n-2通式的链烃一定是炔烃 | |
| B. | 炔烃既易发生加成反应,又易发生取代反应 | |
| C. | 炔烃既能使溴水褪色,也能使酸性高锰酸钾溶液褪色 | |
| D. | 炔烃分子里所有的碳原子都在同一条直线上 |
| A. | 相对分子质量相同、结构不同的化合物一定互为同分异构体 | |
| B. | 结构对称的烷烃,其一氯代物必定只有一种 | |
| C. | 互为同分异构体的化合物不可能具有相同的结构 | |
| D. | 通式为CnH2n且碳原子数不同的有机物一定互为同系物 |
| A. | LiI | B. | NaBr | C. | KCl | D. | CsF |
| A. | 在豆浆里加入盐卤做豆腐 | |
| B. | 在河流入海处易形成沙洲 | |
| C. | 一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路 | |
| D. | FeCl3溶液中滴入NaOH溶液出现红褐色沉淀 |
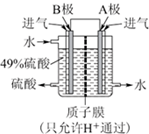 利用原电池原理合成硫酸成为可能,如图利用SO2和O2制备硫酸.其中A、B为多孔材料,可吸附气体.回答下列问题.
利用原电池原理合成硫酸成为可能,如图利用SO2和O2制备硫酸.其中A、B为多孔材料,可吸附气体.回答下列问题.