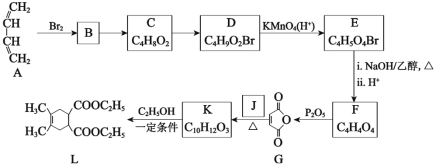
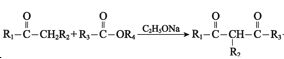
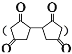
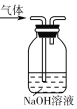
题目内容
【题目】已知由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量。
(1)写出该反应的热化学方程式_________。
(2)若1g水蒸气转化成液态水放热2.494kJ,则反应H2(g)+![]() O2(g)=H2O(l)的ΔH=_____kJ/mol。
O2(g)=H2O(l)的ΔH=_____kJ/mol。
(3)HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和NaOH反应的中和热的热化学方程式为_________。
【答案】H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol [或2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol] -286.7
O2(g)=H2O(g) ΔH=-241.8 kJ/mol [或2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol] -286.7 ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
【解析】
(1)物质燃烧放出的热量与反应物的多少呈正比,先写出氢气燃烧产生气态水的化学方程式,然后根据方程式中氢气的物质的量确定反应放出热量的多少,并注明物质的聚集状态,就得到相应的热化学方程式;
(2)先计算热化学方程式中水蒸气的物质的量的多少,用相应的水的质量乘以1g水蒸气转化为液态水放出的热量就是气态水转化为液态水再放出的热量,据此分析生成液态水的ΔH;
(3)根据中和热是酸、碱的稀溶液发生中和反应产生1mol液态水和可溶性盐时放出的热量计算。
(1)氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量,则氢气燃烧产生水蒸气的化学方程式为H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol,若表示为整数系数,由于物质燃烧放出的热量与物质的量的多少呈正比,因此也可表示为:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol;
O2(g)=H2O(g) ΔH=-241.8 kJ/mol,若表示为整数系数,由于物质燃烧放出的热量与物质的量的多少呈正比,因此也可表示为:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol;
(2)根据热化学方程式H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol可知:反应会产生1mol水,其质量是18g,根据1g水蒸气转化成液态水放热2.494kJ,则反应产生18g液态水时会再放出的热量为2.494kJ/g×18g=44.89kJ,因此1mol氢气完全燃烧生成液态水的热化学方程式为H2(g)+
O2(g)=H2O(g) ΔH=-241.8 kJ/mol可知:反应会产生1mol水,其质量是18g,根据1g水蒸气转化成液态水放热2.494kJ,则反应产生18g液态水时会再放出的热量为2.494kJ/g×18g=44.89kJ,因此1mol氢气完全燃烧生成液态水的热化学方程式为H2(g)+![]() O2(g)=H2O(l) ΔH=-(241.8+44.9) kJ/mol =-286.7kJ/mol;
O2(g)=H2O(l) ΔH=-(241.8+44.9) kJ/mol =-286.7kJ/mol;
(3)HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,H2SO4和NaOH反应产生硫酸钠和水,该反应的中和热是反应产生1mol液态水放出的热量为57.3kJ,所以该反应的中和热的热化学方程式为![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol。
Na2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol。

 小学期末标准试卷系列答案
小学期末标准试卷系列答案