题目内容
【题目】磷是生物体中不可缺少的元素之一,它能形成多种化合物.
(1)磷元素位于周期表的区,基态磷原子中电子占据的最高能层符号为 , 该能层具有的原子轨道数为 .
(2)第三周期中第一电离能位于铝元素和磷元素之间的有种.
(3)白磷(P4)分子是正四面体结构,其键角为 , 磷原子杂化方式为 , 3.1g白磷中σ键的数目为 . P4易溶于二氧化碳,难溶于水,原因是 .
(4)磷酸与Fe3+ 可形成H3[Fe(PO4)2],基态Fe3+的核外电子排布式为 , Fe、P、O电负性由大到小的顺序是
(5)磷化硼是一种超硬耐磨涂层材料,如图为其晶胞,晶胞边长为apm,阿伏伽德罗常数为NA , 则磷化硼晶体的密度为g/cm3(列出计算式即可). 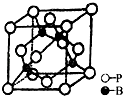
【答案】
(1)p;M;4
(2)2
(3)60°;sp3;0.15mol;P4和CO2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于CO2 , 难溶于水
(4)1s22s22p63s23p63d5;O>P>Fe
(5)![]()
【解析】解:(1)P原子核外有15个电子,分三层排布,即有三个能层,所以电子占据的最高能层符号为M;最外层为3s2p3 , 则磷元素位于周期表的p区,s能级有1个轨道,p能级有3个轨道,所以M能层具有的原子轨道数为4个;所以答案是:p;M;4;(2)同一周期元素自左而右第一电离能呈增大趋势,但P元素原子3p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故铝到磷元素的第一电离能P>S>Si>Al,所以第三周期中第一电离能位于铝元素和磷元素之间的有2种,所以答案是:2;(3)P4分子为正四面体构型,键角为60°,P4分子中每个P原子与相邻的3个P原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,则P原子采取sp3杂化;因为P4分子中每个P原子与相邻的3个P原子形成3个σ键,则平均每个P原子形成1.5个σ键,所以3.1g白磷中σ键的数目为 ![]() ×1.5=0.15mol;
×1.5=0.15mol;
相似相溶原理是指由于极性分子间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,P4和CO2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于CO2 , 难溶于水,
所以答案是:60°;sp3;0.15mol;P4和CO2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于CO2 , 难溶于水;(4)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2 , Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+ , Fe3+电子排布式为1s22s22p63s23p63d5;同周期元素从左到右元素的电负性逐渐增强,则电负性:S>P,同主族元素从上到下电负性逐渐减弱,则电负性:O>S,所以电负性O>P,又Fe为金属元素,则电负性由大到小的顺序是O>P>Fe,所以答案是:1s22s22p63s23p63d5;O>P>Fe;(5)该晶胞中P原子个数=8× ![]() +6×
+6× ![]() =4,B原子个数为4,晶胞边长=a×10﹣10cm,体积V=(a×10﹣10cm)3 , ρ=
=4,B原子个数为4,晶胞边长=a×10﹣10cm,体积V=(a×10﹣10cm)3 , ρ= ![]() =
= 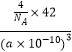 gcm3=
gcm3= ![]() gcm3 ,
gcm3 ,
所以答案是: ![]() gcm3 .
gcm3 .

 名校课堂系列答案
名校课堂系列答案【题目】已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/℃ | 700 | 800 | 900 | 1000 | 1200 |
平衡常数 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H=0(填“<”“>”“=”);
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05molL﹣1 . 则A的平均反应速率v(A)= . 该反应达到平衡时A的转化率为 , 如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为(填“变大”、 “变小”或“不变”)
(3)判断反应是否达到平衡的依据为(填字母代号).
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时,若向另一相同容器中充入0.30molA、0.40mol B、0.40mol C和0.50mol D,此时v正v逆(填“大于”、“小于”或“等于”).
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯 已知: 

密度(g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品 将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是 , 导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品 ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯蒸馏即可得到精品.
【题目】配制某植物营养液可补充氮、磷、钾元素,其成分及含量如表所示:
成分 | 含量 |
硝酸钙 | 260 |
硫酸钾 | 250 |
磷酸二氢铵 | 345 |
硫酸镁 | 537 |
硫酸铵 | 237 |
(1)补充钾元素的物质是 , 其电离方程式为 .
(2)该营养液若在碱性土壤使用,会使氮肥肥效降低,其原因是 .
(3)该营养液中磷元素的浓度为mol/L.