题目内容
【题目】锌一空气燃料电池可作电动车动力电源,电解质溶液为KOH,反应为2Zn+O2+2H2O+4OH﹣=2Zn(OH)42﹣ . 下列说法正确的是( )
A.放电时,电解质溶液中K+移向负极
B.放电时,电解质溶液的pH 不变
C.充电时,阴极的反应为:Zn(OH)42﹣+2e﹣=Zn+4OH﹣
D.充电时,当有4.48L 氧气(标准状况下)释放出来时,则析出固体Zn为13g
【答案】C
【解析】解:A.放电时,为原电池,溶液中阳离子向正极移动,即K+向正极移动,故A错误;B.放电时,消耗氢氧根,碱性减弱,PH值减小,故B错误;
C.充电时,阳极上发生失电子的氧化反应,阴极上发生得电子的氧化反应,则阴极反应为:Zn(OH)42﹣+2e﹣=Zn+4OH﹣ , 故C正确;
D.产生1mol氧气,转移电子为4mol,充电时,当有4.48L 氧气(标准状况下)释放出来时,转移电子物质的量为: ![]() ×4=0.8mol,根据Zn~2e﹣ , 则析出固体Zn为:
×4=0.8mol,根据Zn~2e﹣ , 则析出固体Zn为: ![]() ×65g/mol=26g,故D错误;
×65g/mol=26g,故D错误;
故选C.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域.用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素.反应的方程式为:CO(NH2)2+H2O2 ![]() CO(NH2)2H2O2 . 过氧化尿素的部分性质如下:
CO(NH2)2H2O2 . 过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
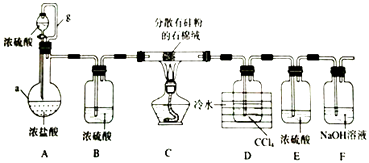
合成过氧化尿素的流程(如图1)及反应装置图2:
请回答下列问题:
(1)仪器X的名称是;冷凝管中冷却水从(填“a”或“b”)口进入;
(2)反应器的加热方式是 .
(3)搅拌器是否可用铁质材料(填“是”或“否”),原因是;
(4)步骤①采用减压蒸发的原因是 .
(5)母液可以循环使用提高原料利用率,若欲从母液中分离出H2O2和尿素,可采用的操作是 .
A.盐析、过滤
B.减压蒸馏、结晶
C.分液、过滤
D.常压蒸馏、萃取
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6molL﹣1 H2SO4 , 用0.1000molL﹣1 KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2H2O2的质量分数为;若滴定前滴定管尖嘴处有气泡,滴定后消失,则测得的过氧化尿素含量(填“偏高”、“偏低”或“不变”).