题目内容
【题目】党的十九大报告指出:要持续实施大气污染防治行动,打赢蓝天保卫战。当前空气质量检测的主要项目除了PM2.5外,还有CO、SO2、氮氧化物(NO和NO2)、O3等气体。
(1)汽车尾气中含有NO和CO气体,可利用催化剂对CO、NO进行催化转化反应:
2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
①已知下列热化学方程式:
N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) △H2=-2210kJ/mol
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol
则△H=_________。
②在一定温度下,将2.0molNO、2.4molCO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如下图所示。在0~15min,以N2表示的该反应的平均速度v(N2)=________。若保持反应体系温度不变,20min时再容器中充入NO、N2各0.4mol,化学平衡将_____移动(填“向左”“向右”或“不”)。

(2)在相同温度下,两个体积均为1L的恒容密闭容器中,发生CO、NO催化转化反应,有关物质的量如下表:
容器编号 | 起始物质的量/mol | 平衡物质的量/mol | |||
NO | CO | N2 | CO2 | CO2 | |
I | 0.2 | 0.2 | 0 | 0 | a |
II | 0.3 | 0.3 | b | 0.1 | 0.2 |
①容器I中平衡后气体的压强为开始时的0.875倍,则a=________。
②容器II平衡时的气体压强为p,用平衡分压代替平衡浓度表示的平衡常数K为________。
(3)汽车使用乙醇汽油并不能破少NOx的排放。某研究小组在实验室以耐高温试剂Ag-ZSW-5对CO、NO催化转化进行研究。测得NO转化为N2的转化率随温度CO混存量的变化情况如图所示。

①在n(NO)/n(CO)=1条件下,最佳温度应控制在_______左右。
②若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为________。
③加入CO后NO转化为N2的转化率增大的原因是_______ (用平衡移动的原理解释)。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电极反应式为_______。

【答案】 -746.5kJ·mol- 1 0.013mol/(L·min) 左 0.1 4/p 870K (860~880K 范围都可以) NO直接分解成 N2的反应是放热反应,升高温度不利于反应进行 加入的 CO与NO分解生成的O2反应,使 NO分解平衡向生成 N2的方向移动,因此NO转化率升高 NO2+NO3--e-=N2O5
【解析】(1)①根据盖斯定律:③×2-②-①,整理可得:2CO(g)+2NO(g) ![]() N2(g)+2CO2(g)△H= -746.5kJ·mol- 1,正确答案:-746.5kJ·mol- 1。
N2(g)+2CO2(g)△H= -746.5kJ·mol- 1,正确答案:-746.5kJ·mol- 1。
②由图可以知道, 15min内,N2浓度变化量为![]() ,则
,则![]()
![]() ;将
;将![]() NO、
NO、![]() CO通入到固定容积为2L的容器中,则:
CO通入到固定容积为2L的容器中,则:
2CO(g)+2NO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始浓度: 1.2 1 0 0
变化浓度: 0.4 0.4 0.2 0.4
平衡浓度: 0.8 0.6 0.2 0.4
化学平衡常数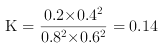 ;
;![]() 时再向容器中充入NO、
时再向容器中充入NO、![]() 各0.4 mol,此时各成分的浓度变为c(CO)=0.8mol/L、c(NO)= 0.8mol/L、 c(N2)=0.4mol/L、 c( CO2)=0.4mol/L;浓度商为(0.4)2×(0.4)2/(0.8)2×(0.8)2=0.156>0.14,反应向左进行;正确答案:0.013mol/(L·min); 左。
各0.4 mol,此时各成分的浓度变为c(CO)=0.8mol/L、c(NO)= 0.8mol/L、 c(N2)=0.4mol/L、 c( CO2)=0.4mol/L;浓度商为(0.4)2×(0.4)2/(0.8)2×(0.8)2=0.156>0.14,反应向左进行;正确答案:0.013mol/(L·min); 左。
(2)容器的体积为1L, 根据表格中容器I的数据,列出三段式:
2CO(g)+2NO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始浓度: 0.2 0.2 0 0
变化浓度: a a 0.5 a a
平衡浓度: 0.2-a 0.2-a 0.5 a a
已知容器I中平衡后气体的压强为开始时的0.875倍,恒温条件下,气体的压强之比等于气体的物质的量之比:0.2-a+0.2-a+0.5a+a=0.875×(0.2+0.2),a=0.1 mol; 容器I与容器II温度相同,平衡常数相等;容器的体积为1L,容器容器I中的化学平衡常数为K=c(N2)×c(CO2)2/ c(NO)2 c(CO)2=0.5×0.1×(0.1)2/(0.1)2×(0.1)2=5;容器II中根据表格数据可三段式:
2CO(g)+2NO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始浓度: 0.3 0.3 b 0.1
变化浓度: 0.1 0.1 0.05 0.1
平衡浓度: 0.2 0.2 b-0.05 0.2
则K=c(N2)×c(CO2)2/ c(NO)2 ×c(CO)2= (b-0.05)×(0.2)2/(0.2)2×(0.2)2=5,解之得b=0.25;则平衡时气体的总量为0.8mol,各组分气体均为0.2 mol,各气体的分压均为p /4 ;用平衡分压代替平衡浓度表示的平衡常数K= p/4×(p/4)2/(p/4)2×(p/4)2=4/p;正确答案:0.1;4/p。
(3) ①由图可知:在n(NO)/n(CO)=1条件下,温度为870K左右时,一氧化氮还原为氮气的的转化率最高,正确答案:870K (860~880K 范围都可以)。
②升高温度,发现一氧化氮的分解率降低,说明反应左移,该反应为放热反应;正确答案:NO直接分解成 N2的反应是放热反应,升高温度不利于反应进行,因此NO转化率升高。
③加入CO会与NO的分解的产物氧气反应,促进了NO分解平衡向生成 N2的方向移动,因此NO转化率升高;正确答案:加入的 CO与NO分解生成的O2反应,使 NO分解平衡向生成 N2的方向移动,因此NO转化率升高。
(4)通入氧气的一极发生还原反应,为燃料电池的正极;通入NO2气体的一极为燃料电池的负极,发生氧化反应,且NO2被氧化为五氧化二氮;则该电极反应式为:NO+NO3--e-=N2O5;正确答案:NO2+NO3--e-=N2O5。

 名校课堂系列答案
名校课堂系列答案【题目】亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。实验室用如图所示装置制备亚硝酸钠。请回答下列问题:
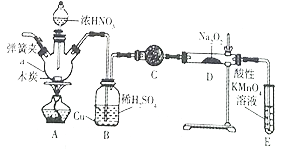
已知:①3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
(1)仪器a的名称是_____________。
(2)B装置中的主要现象是_______。C中的试剂可以是____________。
(3)D中反应生成NaNO2的化学方程式为_______。E装置的作用是______________。
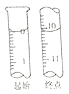
(4)检验D装置中生成NaNO2
操作 | 现象 | 结论 |
_____________ | ____________ | 有NaNO2生成 |
(5) NaNO2有毒,国家规定肉制品中NaNO2含量不能超过30mg/kg。从1000g隔夜熟肉中提取NaNO2后,配成溶液,再用0.0050mol/L的酸性高锰酸钾溶液滴定,滴定起始和终点的液面位置如图所示,计算隔夜熟肉中NaNO2的含量是_______mg/kg。