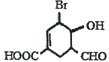
题目内容
【题目】A、B、C、D、E五种元素的原子序数依次增大,A原子无中子,B的单质在空气中含量最多,C、D元素同主族且原子序数D为C的二倍,E元素的价电子排布式为(n-l)dn+6ns1。回答下列问题:
(1)元素B在周期表中的位置是___________________;E元素的元素符号为_______,
(2)D元素基态原子的价电子轨道排布图为_______。
(3)A元素与C元素形成两种常见的化合物,其原子个数比分别为2:1和1:1,两种化合物可以任意比互溶,主要原因是_____________________;其中一种化合物可在酸性条件下将KMnO4还原为Mn2+,相关反应的离子方程式为____________________。
【答案】 第2周期第VA族(第二周期第五主族) Cu ![]() 相似相溶,分子间形成氢键 5H2O2 +2MnO4-+6H+====2Mn2++5O2↑+8H2O
相似相溶,分子间形成氢键 5H2O2 +2MnO4-+6H+====2Mn2++5O2↑+8H2O
【解析】A、B、C、D、E五种元素的原子序数依次增大,A原子无中子则A为氢元素,B的单质在空气中含量最多则B为氮元素,C、D元素同主族且原子序数D为C的二倍则C为氧元素,D为硫元素,E元素的价电子排布式为(n-l)dn+6ns1即3d94s1,则E为铜元素;(1)元素B为氮元素,在周期表中的位置是第二周期第VA族;E为铜元素,元素符号为Cu;(2)D为硫元素,硫原子的最外层电子排布式3s23p4,价层电子轨道排布图为:![]() ;(3)A元素与C元素形成两种常见的化合物,其原子个数比分别为2:1和1:1分别为H2O和H2O2,两种化合物可以任意比互溶,主要原因是相似相溶,分子间形成氢键;其中一种化合物H2O2可在酸性条件下将KMnO4还原为Mn2+,相关反应的离子方程式为5H2O2 +2MnO4-+6H+====2Mn2++5O2↑+8H2O。
;(3)A元素与C元素形成两种常见的化合物,其原子个数比分别为2:1和1:1分别为H2O和H2O2,两种化合物可以任意比互溶,主要原因是相似相溶,分子间形成氢键;其中一种化合物H2O2可在酸性条件下将KMnO4还原为Mn2+,相关反应的离子方程式为5H2O2 +2MnO4-+6H+====2Mn2++5O2↑+8H2O。

【题目】党的十九大报告指出:要持续实施大气污染防治行动,打赢蓝天保卫战。当前空气质量检测的主要项目除了PM2.5外,还有CO、SO2、氮氧化物(NO和NO2)、O3等气体。
(1)汽车尾气中含有NO和CO气体,可利用催化剂对CO、NO进行催化转化反应:
2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
①已知下列热化学方程式:
N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) △H2=-2210kJ/mol
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol
则△H=_________。
②在一定温度下,将2.0molNO、2.4molCO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如下图所示。在0~15min,以N2表示的该反应的平均速度v(N2)=________。若保持反应体系温度不变,20min时再容器中充入NO、N2各0.4mol,化学平衡将_____移动(填“向左”“向右”或“不”)。

(2)在相同温度下,两个体积均为1L的恒容密闭容器中,发生CO、NO催化转化反应,有关物质的量如下表:
容器编号 | 起始物质的量/mol | 平衡物质的量/mol | |||
NO | CO | N2 | CO2 | CO2 | |
I | 0.2 | 0.2 | 0 | 0 | a |
II | 0.3 | 0.3 | b | 0.1 | 0.2 |
①容器I中平衡后气体的压强为开始时的0.875倍,则a=________。
②容器II平衡时的气体压强为p,用平衡分压代替平衡浓度表示的平衡常数K为________。
(3)汽车使用乙醇汽油并不能破少NOx的排放。某研究小组在实验室以耐高温试剂Ag-ZSW-5对CO、NO催化转化进行研究。测得NO转化为N2的转化率随温度CO混存量的变化情况如图所示。

①在n(NO)/n(CO)=1条件下,最佳温度应控制在_______左右。
②若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为________。
③加入CO后NO转化为N2的转化率增大的原因是_______ (用平衡移动的原理解释)。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电极反应式为_______。