题目内容
下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置图。
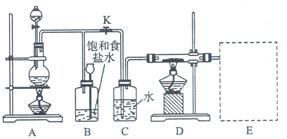
(1)A是氯气发生装置,其中发生反应的离子方程式为 。
(2)实验开始时,先点燃A处酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。则该反应的化学方程式为 ,装置C的作用是
(3) 该装置图尚未画完,请在E处补充完整,并注明试剂名称。
(4)D处反应完结后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,则B的作用是 。

(1)A是氯气发生装置,其中发生反应的离子方程式为 。
(2)实验开始时,先点燃A处酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。则该反应的化学方程式为 ,装置C的作用是
(3) 该装置图尚未画完,请在E处补充完整,并注明试剂名称。
(4)D处反应完结后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,则B的作用是 。
(1) MnO2+4H++2Cl-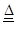 Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
(2) C+2Cl2+2H2O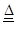 CO2+4HCl , 提供水蒸汽
CO2+4HCl , 提供水蒸汽
(4) 储存氯气
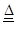 Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑(2) C+2Cl2+2H2O
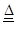 CO2+4HCl , 提供水蒸汽
CO2+4HCl , 提供水蒸汽 (4) 储存氯气
试题分析:(1) MnO2+4H++2Cl-
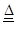 Mn2++2H2O+Cl2↑ 注意MnO2写化学式,浓盐酸拆成离子形式,注意配平。(2)C+2Cl2+2H2O
Mn2++2H2O+Cl2↑ 注意MnO2写化学式,浓盐酸拆成离子形式,注意配平。(2)C+2Cl2+2H2O 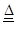 CO2+4HCl,C提供水蒸汽(3)注意收集气体装置。
CO2+4HCl,C提供水蒸汽(3)注意收集气体装置。(4)B的作用是储存氯气
点评:氯气的制取实验是历年高考的重点和难点,本题在旧的知识上有新的拓展,注意氯气的制备装置,即可找到突破口。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目