题目内容
【题目】废定影液的主要成分为Na3[Ag(S2O3)2],用废定影液为原料制备AgNO3的实验流程如下:

(1) “沉淀”步骤中生成Ag2S沉淀,检验沉淀完全的操作是________。
(2) “反应”步骤中会生成淡黄色固体,该反应的化学方程式为________。
(3) “除杂”需调节溶液pH至6。测定溶液pH的操作是________。
(4) 已知:2AgNO3![]() 2Ag+2NO2↑+O2↑,2Cu(NO3)2
2Ag+2NO2↑+O2↑,2Cu(NO3)2![]() 2CuO+4NO2↑+O2↑。AgNO3粗产品中常含有Cu(NO3)2,请设计由AgNO3粗产品获取纯净AgNO3的实验方案:______________________,蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得到纯净的AgNO3。(实验中须使用的试剂有稀硝酸、NaOH溶液、蒸馏水)
2CuO+4NO2↑+O2↑。AgNO3粗产品中常含有Cu(NO3)2,请设计由AgNO3粗产品获取纯净AgNO3的实验方案:______________________,蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得到纯净的AgNO3。(实验中须使用的试剂有稀硝酸、NaOH溶液、蒸馏水)
(5) 蒸发浓缩AgNO3溶液的装置如下图所示。使用真空泵的目的是________;判断蒸发浓缩完成的标志是____________________。
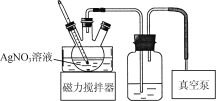
【答案】静置,向上层清液中继续滴加Na2S溶液,若不再有沉淀生成,则说明沉淀已经完全 Ag2S+4HNO3===2AgNO3+2NO2↑+S+2H2O 用洁净的玻璃棒蘸取反应液,滴在pH试纸上,与标准比色卡对照 将AgNO3粗产品加热并维持温度在200 ℃至恒重,同时用足量NaOH溶液吸收产生的气体,待固体残留物冷却后,加入蒸馏水,充分溶解、过滤、洗涤,并将洗涤液与滤液合并,再加入适量稀硝酸 使体系形成负压,有利于水分在较低温度下蒸发,同时可防止AgNO3分解 溶液表面有晶膜出现
【解析】
废定影液的主要成分为Na3[Ag(S2O3)2],用硫化钠沉淀,生成Ag2S沉淀,过滤得到滤渣,洗涤干净后加入浓硝酸溶解Ag2S得到硝酸银、硫单质与二氧化氮;用氢氧化钠除去过量的硝酸得到硝酸银溶液,蒸发浓缩、冷却结晶得到硝酸银晶体,据此分析作答。
(1)沉淀过程是Na3[Ag(S2O3)2]与Na2S反应制得Ag2S的反应,检验沉淀完全的操作是:静置,向上层清液中继续滴加Na2S溶液,若不再有沉淀生成,则说明沉淀已经完全;
(2)“反应”步骤中会生成淡黄色固体,根据元素守恒可知,该淡黄色沉淀为硫离子被氧化的产物硫单质,根据氧化还原反应规律可知其化学方程式为:Ag2S+4HNO3===2AgNO3+2NO2↑+S+2H2O;
(3)测定溶液pH的基本操作是:用洁净的玻璃棒蘸取反应液,滴在pH试纸上,与标准比色卡对照;
(4)根据给定的已知信息可知,硝酸铜的分解温度为200 ℃,硝酸银的分解温度在440 ℃,则可设计除去硝酸铜的方法为:将AgNO3粗产品加热并维持温度在200 ℃至恒重,同时用足量NaOH溶液吸收产生的气体,待固体残留物冷却后,加入蒸馏水,充分溶解、过滤、洗涤,并将洗涤液与滤液合并,再加入适量稀硝酸;
(5)考虑硝酸银易分解,而实验装置中真空泵可以形成负压,有利于水分在较低温度下蒸发,同时可防止AgNO3分解;蒸发浓缩过程中,若溶液表面有晶膜出现,则证明蒸发浓缩完成。