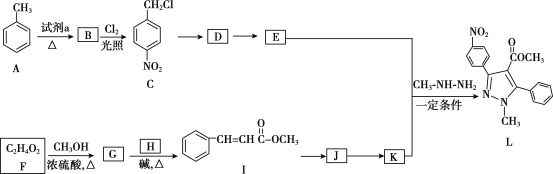
题目内容
【题目】常温下,向![]() 溶液中滴加少量
溶液中滴加少量![]() 溶液,反应原理如图所示。关于该反应过程的说法正确的是
溶液,反应原理如图所示。关于该反应过程的说法正确的是

A.该反应过程中,![]() 是
是![]() 是
是![]() B.当有
B.当有![]() 生成时,转移
生成时,转移![]() 电子
电子
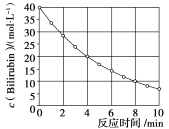
C.在![]() 分解过程中,溶液的
分解过程中,溶液的![]() 逐渐降低D.
逐渐降低D.![]() 的氧化性比
的氧化性比![]() 强,还原性比
强,还原性比![]() 弱
弱
【答案】B
【解析】
根据反应原理图,H2O2+M+H+→H2O+Mˊ的过程中H2O2被还原成H2O,Mˊ+H2O2→M+O2+H+的过程中H2O2被氧化成O2,根据氧化还原反应的特点,M为Fe2+,Mˊ为Fe3+,据此分析作答。
A. 根据分析, M是![]() ,Mˊ是
,Mˊ是![]() ,故A错误;
,故A错误;
B. 图示中生成O2的反应为2Fe3++H2O2=2Fe2++O2↑+2H+,反应过程中O元素的化合价由-1价升至0价,因此当有![]() 生成时,转移
生成时,转移![]() 电子,故B正确;
电子,故B正确;
C. 图示中的反应为2Fe3++H2O2=2Fe2++O2↑+2H+、2Fe2++H2O2+2H+=2Fe3++2H2O,则总反应为2H2O2![]() 2H2O+O2↑,在
2H2O+O2↑,在![]() 分解过程中生成了H2O,溶液变稀,则溶液的
分解过程中生成了H2O,溶液变稀,则溶液的![]() 会逐渐增大,故C错误;
会逐渐增大,故C错误;
D. 根据2Fe3++H2O2=2Fe2++O2↑+2H+说明H2O2的还原性强于Fe2+,2Fe2++H2O2+2H+=2Fe3++2H2O说明H2O2的氧化性强于Fe3+,故D错误;
综上所述,答案为B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目