题目内容
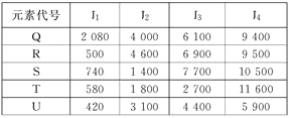
【题目】根据下列五种元素的电离能数据(单位:kJ·mol-1),回答下列各题。
(1)在周期表中,最可能处于同一族的是________(填字母,下同)。
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)它们的氯化物的化学式,最可能正确的是________。
A.QCl2 B.RCl C.SCl3 D.TCl E.UCl4
(3)S元素最可能是________。
A.s区元素 B.稀有气体元素 C.p区元素 D.准金属 E.d区元素
(4)下列元素中,化学性质和物理性质最像Q元素的是________。
A.硼(1s22s22p1) B.铍(1s22s2) C.锂(1s22s1) D.氢(1s1) E.氦(1s2)
【答案】E B A E
【解析】
电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫第一电离能,气态基态正一价阳离子失去一个电子转化为气态基态正二价阳离子所需要的最低能量叫第二电离能……。元素的原子第一电离能越小,表示气态时越容易失去电子,即该元素在气态时的金属性越强。由此分析。
(1)由表中数据可知,R元素的第二电离能约为第一电离能的9.2倍,第三电离能约为第二电离能的1.5倍,第四电离能约为第三电离能的1.4倍,说明R原子最外层只有一个电子;同样,U元素的第二电离约为第一电离能的7.4倍,第三电离能约为第二电离能的1.4倍,第四电离能约为第三电离能的1.3倍,说明U原子最外层也只有一个电子;所以R和U最可能处于同一族,答案选E。
(2)A.分析Q元素的I1、I2、I3、I4可知,后一级电离能都约为前一级电离的1~2倍,差别不大,因此这4个电子很可能都在最外层上,所以其氯化物的化学式不可能是QCl2,A项错误; B.由(1)分析可知R原子最外层只有1个电子,且第一电离能很小,说明R易失去1个电子显+1价,所以其氯化物的化学式为RCl,B项正确;C.S元素的第三电离能约为第二电离能的5.5倍,明显大于其它相邻电离能的倍数,所以S原子最外层最可能是2个电子,又因S原子第一电离能较小,所以S原子易显+2价,它的氯化物的化学式最可能是SCl2,C项错误;D.T元素的第四电离能大约是第三电离能的4.3倍,明显大于其它相邻电离能的倍数,故T原子最外层最可能是3个电子,又因T元素的第一电离能较小,所以T易显+3价,其氯化物的化学式最可能是TCl3,D项错误;E.由(1)分析可知U原子最外层只有1个电子,且第一电离能很小,说明U原子易失去1个电子显+1价,所以其氯化物的化学式为UCl,E项错误;答案选B。
(3) S元素的第三电离能约为第二电离能的5.5倍,明显大于其它相邻电离能的倍数,所以S原子最外层最可能是2个电子(核外电子数越过2个,不可是He),S元素最外层能级上电子排布是ns2,所以S元素最可能是s区。答案选A。
(4)由表格数据可知,Q元素的第一电离能特别大,说明Q原子很难失去电子,化学性质很稳定,所以只有稀有气体元素氦的化学性质和物理性质最像Q元素,答案选E。

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案