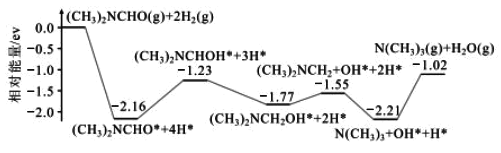
题目内容
【题目】三氯氧磷(POCl3)广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸(H3PO3)。请回答下列问题:
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为__________。
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为_______。
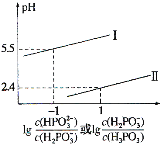
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。则表示lg![]() 的是曲线______(填“I”或“II”),亚磷酸(H3PO3)的Kal=________,反应HPO32-+H2O
的是曲线______(填“I”或“II”),亚磷酸(H3PO3)的Kal=________,反应HPO32-+H2O![]() H2PO3-+OH-的平衡常数值是____________。
H2PO3-+OH-的平衡常数值是____________。
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=________mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
【答案】PCl3+Cl2+H2O![]() POCl3+2HCl c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+) I 10-1.4 10-7.5 4×10-7
POCl3+2HCl c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+) I 10-1.4 10-7.5 4×10-7
【解析】
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,三氯氧磷为POCl3,实际上为PCl3与Cl2反应生成PCl5,PCl5水解生成POCl3;
(2)亚磷酸(H3PO3)为二元弱酸,则HPO32-不能再发生电离,只能水解,使溶液呈碱性,据此分析;
(3)根据H3PO3的电离平衡常数,![]() ,
,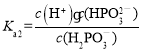 ,则lg
,则lg![]() =lg
=lg![]() ,lg
,lg![]() =lg
=lg![]() ,第一步电离平衡常数远远大于第二步电离平衡常数;
,第一步电离平衡常数远远大于第二步电离平衡常数;
(4)根据CaSO4的溶度积常数计算。
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,三氯氧磷为POCl3,实际上为PCl3与Cl2反应生成PCl5,PCl5水解生成POCl3,发生的化学反应为:PCl3+Cl2+H2O![]() POCl3+2HCl;
POCl3+2HCl;
(2)亚磷酸(H3PO3)为二元弱酸,则HPO32-不能再发生电离,只能水解,使溶液呈碱性,同时考虑到水也存在电离平衡,所以溶液中c(H2PO3-)<c(OH-),因此溶液中离子浓度大小顺序为:c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+),故答案为:c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+);
(3)根据H3PO3的电离平衡常数,![]() ,
,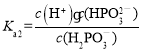 ,则lg
,则lg![]() =lg
=lg![]() ,lg
,lg![]() =lg
=lg![]() ,Ka1>>Ka2,则pH值相同时,即纵坐标相同时,lg
,Ka1>>Ka2,则pH值相同时,即纵坐标相同时,lg![]() > lg
> lg![]() ,即lg
,即lg![]() 横坐标大,则曲线I表示的是lg
横坐标大,则曲线I表示的是lg![]() 曲线II表示的是 lg
曲线II表示的是 lg![]() ;
;![]() ,根据图像可知当pH=2.4时,lg
,根据图像可知当pH=2.4时,lg![]() =1,即当溶液中c(H+)=10-2.4mol/L时,
=1,即当溶液中c(H+)=10-2.4mol/L时,![]() =10,则
=10,则![]() =10-2.4×10=10-1.4;反应HPO32-+H2O
=10-2.4×10=10-1.4;反应HPO32-+H2O![]() H2PO3-+OH-的平衡常数值
H2PO3-+OH-的平衡常数值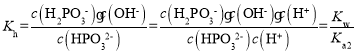 ,根据图像可知当pH=5.5时,lg
,根据图像可知当pH=5.5时,lg![]() =-1,即当溶液中c(H+)=10-5.5mol/L时,
=-1,即当溶液中c(H+)=10-5.5mol/L时,![]() =0.1,所以
=0.1,所以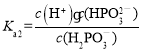 =10-5.5×0.1=10-6.5,Kh=
=10-5.5×0.1=10-6.5,Kh=![]() ,故答案为:I;10-1.4;10-7.5;
,故答案为:I;10-1.4;10-7.5;
(4)Ksp[Ca3(PO4)2]= c3(Ca2+)·c(PO43-),处理后的废水中c(Ca2+)=5×10-6mol/L,则溶液中c(PO43-)= 。
。

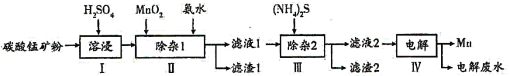
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐及SiO2杂质)为原料生产金属锰的工艺流程如下:
已知25℃时,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤I中,为加快溶浸速率,可采取的措施是__________(至少答两条)。
(2)步骤II中,加氨水调节溶液的pH为5.0~6.0,则滤渣1的成分主要为________(填化学式);已知MnO2的作用为氧化剂,“除杂1”中涉及的离子方程式为NH3·H2O+H+=NH4++H2O、_____________、___________。
(3)步骤中,所加(NH4)2S的浓度不宜过大的原因是______________。
(4)滤液2中,c(Co2+):c(Ni2+)=____________。
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如表所示:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为________,加碱调节pH为________时,铁刚好沉淀完全(离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为________时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是______________,原因是________。