题目内容
在加入铝粉能放出氢气的溶液中,下列各组离子可能大量共存的是
| A.NH4+、NO3-、CO32-、Na+ | B.Na+、Ba2+、HCO3-、AlO2- |
| C.NO3-、K+、AlO2-、OH- | D.NO3-、Mg 2+、K+、CH3COO- |
C
试题分析:加入铝粉能放出氢气的溶液可能呈酸性,也可能呈碱性。A.在酸性溶液中发生反应:CO32-+2H+ =CO2↑+H2O;在碱性溶液中发生反应:NH4++OH-= NH3↑+H2O.因此无论是酸性还是碱性溶液都不能大量存在。错误。B.在酸性溶液中发生反应HCO3-+H+=CO2↑+H2O;AlO2-+4H+=Al3++2H2O.不能大量存在;在碱性溶液中发生反应:HCO3-+OH-=H2O+ CO32-不能大量存在。错误。C.在碱性溶液中发生反应这些离子不会发生任何反应,可以大量共存。正确。D.在酸性溶液中发生反应:CH3COO-+H+= CH3COOH;在碱性溶液中发生反应:Mg 2++2OH-=Mg(OH)2↓.都不能大量存在。错误。

练习册系列答案
相关题目
 H2CO3 H2CO3
H2CO3 H2CO3 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、 、
、 、
、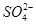 ,已知:
,已知: