题目内容
【题目】某烧碱样品因部分变质含Na2CO3。某化学课外小组的同学用滴定法测定该烧碱样品中NaOH的质量分数。
(资料)常用的酸碱指示剂及其变色范围如下:
酚酞:pH<8.2 无色 8.2<pH<10浅红色 pH>10 红色
甲基橙:pH<3.1红色 3.1<pH<4.4橙色 pH>4.4 黄色
(实验步骤)
I. 迅速地称取烧碱样品0.50g,溶解后配制成100 mL溶液,备用。
Ⅱ.将0.1000mol/L HCl标准溶液装入酸式滴定管,调零,记录起始读数V0;用碱式滴定管取20.00 mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为NaCl和NaHCO3),记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数V2。重复上述操作两次,记录数据如下:
实验序号 | 1 | 2 | 3 |
V0/ mL | 0.00 | 0.00 | 0.00 |
V1/ mL | 21.72 | 21.68 | 21.70 |
V2/ mL | 23.72 | 23.68 | 23.70 |
(1)步骤I中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和________。
(2)下列有关步骤I中样品溶液的说法正确的是________(填字母序号)。
a. 样品溶液中水的电离程度比相同pH的NaOH溶液中的小
b. c(OH-)>c(CO32-)>c(HCO3-)
c. c(H+)+ c(Na+)=c(CO32-)+c(HCO3-)+ c(OH-)
d. 向该溶液中滴加盐酸至第一终点时,n(Cl-)+n(CO32-)+n( HCO3-)+n(H2CO3)=n(Na+)
(3)酸式滴定管用蒸馏水洗净后、装入标准溶液前,应进行的操作是_______。
(4)滴定至第一终点的过程中,发生反应的离子方程式为_____。
(5)判断滴定至第二终点的现象是溶液由___色变为橙色。
(6)样品中NaOH的质量分数w(NaOH)= _____%。(计算结果保留小数点后1位)
(7)下列操作会导致测得的NaOH质量分数偏高的是____(填字母序号)。
a. 达到第一终点前,锥形瓶中有气泡产生
b. 记录酸式滴定管读数V1时,俯视标准液液面
c. 第一终点后继续滴定时,锥形瓶中有少许液体溅出
【答案】100 mL容量瓶 bd 用HCl标准溶液润洗酸式滴定管 H+ + OH-=H2O H+ + CO32-=HCO3- 黄 78.8 ac
【解析】
(1)根据配制溶液的体积分析;
(2)根据影响水电离的因素、电荷守恒、物料守恒分析;
(3)滴定管先水洗再润洗;
(4)滴定至第一终点的过程中,盐酸与氢氧化钠、碳酸钠依次发生反应;
(5)根据甲基橙的变色范围判断滴定至第二终点的现象;
(6)根据表格数据,碳酸氢钠生成二氧化碳消耗盐酸的体积为23.70-21.70=2mL,氢氧化钠消耗盐酸的体积是21.70-(23.70-21.70)=19.70 mL;
(7)达到第一终点消耗的盐酸多,则氢氧化钠的质量分数越大。
(1)步骤I是准确配制100mL溶液,所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和100mL容量瓶;
(2)a. 样品溶液中的氢氧根离子主要由氢氧化钠电离和碳酸钠水解共同提供,NaOH溶液中的氢氧根离子主要由氢氧化钠电离,所以氢氧化钠溶液中氢氧化钠的浓度大于样品溶液中氢氧化钠的浓度,样品溶液中水的电离程度比相同pH的NaOH溶液中的大,故a错误;
b. 根据表格数据,碳酸氢钠生成二氧化碳消耗盐酸的体积为23.70-21.70=2mL,氢氧化钠消耗盐酸的体积是21.70-(23.70-21.70)=19.70 mL,氢氧化钠的物质的量大于碳酸钠,所以c(OH-)>c(CO32-)>c(HCO3-),故b正确;
c. 根据电荷守恒,c(H+)+ c(Na+)=2c(CO32-)+c(HCO3-)+ c(OH-),故c错误;
d. 向该溶液中滴加盐酸至第一终点时,溶质为NaCl和NaHCO3,根据物料守恒,n(Cl-)+n(CO32-)+n( HCO3-)+n(H2CO3)=n(Na+),故d正确。
(3)滴定管先水洗再润洗,酸式滴定管用蒸馏水洗净后、装入标准溶液前,应进行的操作是用HCl标准溶液润洗酸式滴定管;
(4)滴定至第一终点的过程中,盐酸与氢氧化钠、碳酸钠依次发生反应,反应离子方程式是H+ + OH-=H2O 、 H+ + CO32-=HCO3-;
(5)根据甲基橙的变色范围,滴定至第二终点的现象是溶液由黄色变为橙色;
(6)根据表格数据,碳酸氢钠生成二氧化碳消耗盐酸的体积为23.70-21.70=2mL,氢氧化钠消耗盐酸的体积是21.70-(23.70-21.70)=19.70 mL;所以氢氧化钠的物质的量是0.1 mol/L×0.0197L=0.00197mol,氢氧化钠的质量是0.00197mol×40g/mol=0.0788g,样品中NaOH的质量分数w(NaOH)= 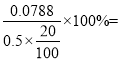 78.8%。
78.8%。
(7)a. 达到第一终点前,锥形瓶中有气泡产生,达到第一终点消耗的盐酸多,测得的NaOH质量分数偏高,故选a;
b. 记录酸式滴定管读数V1时,俯视标准液液面,达到第一终点消耗的盐酸少,测得的NaOH质量分数偏低,故不选b;
c. 第一终点后继续滴定时,锥形瓶中有少许液体溅出,第二次滴定消耗的盐酸少,达到第一终点消耗的盐酸多,测得的NaOH质量分数偏高,故选c;

【题目】白桦脂酸对白血病等恶性肿瘤细胞有抑制作用,其结构简式如图所示,在白桦脂酸中加入合适的试剂检验其官能团(必要时可加热),下列试剂、现象、结论都正确的一项是
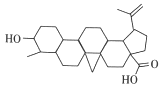
选项 | 试剂 | 现象 | 结论 |
A | 氯化铁溶液 | 溶液变色 | 含有羟基 |
B | 银氨溶液 | 有银镜产生 | 含有醛基 |
C | 碳酸氢钠溶液 | 有气泡产生 | 含有羧基 |
D | 酸性KMnO4溶液 | 溶液褪色 | 含有碳碳双键 |
A. AB. BC. CD. D