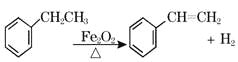
题目内容
【题目】现有下列九种物质:①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)上述状态下可导电的是;
属于电解质的是;
属于非电解质的是 .
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为 .
(3)⑨在水中的电离方程式为 , 34.2g ⑨溶于水配成250mL溶液,SO42﹣的物质的量浓度为 .
【答案】
(1)②⑦⑧⑨;③⑤⑥⑨;④
(2)Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
(3)Al2(SO4)3=2Al3++3SO42﹣;1.2mol/L
【解析】解:(1)②铝中含有自由电子,⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3都存在自由移动的离子,所以能够导电;
③CuO ⑤H2SO4 ⑥Ba(OH)2固体⑨熔融Al2(SO4)3都是化合物,在水溶液或者熔融状态下能够导电,属于电解质;
④CO2自身不能电离出自由移动离子,不能导电属于非电解质;
所以答案是:②⑦⑧⑨;③⑤⑥⑨;④;(2)硝酸与氢氧化钡反应的实质是氢离子与氢氧根离子反应生成水,可以用离子方程式H++OH﹣═H2O表示,对应反应为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
所以答案是:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;(3)硫酸铝在水中电离产生铝离子和硫酸根离子,电离方程式为:Al2(SO4)3=2Al3++3SO42﹣;
硫酸铝的物质的量= ![]() =0.1mol,硫酸根离子的物质的量=0.1mol×3=0.3mol,硫酸根离子的物质的量浓度=
=0.1mol,硫酸根离子的物质的量=0.1mol×3=0.3mol,硫酸根离子的物质的量浓度= ![]() =1.2mol/L;
=1.2mol/L;
所以答案是:Al2(SO4)3=2Al3++3SO42﹣;1.2mol/L.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】课外实验小组为了探究锌与盐酸反应过程中的化学反应速率的变化,在100mL稀盐酸中加入足量的锌粉,标准状况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min,下同)反应速率最大,可能的原因 .
(2)哪一段时段的反应速率最小 , 原因是 .
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为 .
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.蒸馏水
B.CH3COONa固体
C.Na2CO3溶液
D.CuSO4溶液你认为可行的是(填编号).
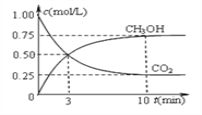
【题目】按照下列图表和有关要求回答问题:
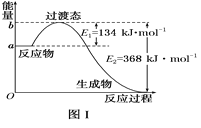
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_________(填“增大”“减小”或“不变”,下同),ΔH的变化是_________。请写出NO2和CO反应的热化学方程式:___________________________。
(2) 甲醇既是重要的化工原料,又可作为燃料。
Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) ΔH1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=_________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=______kJ·mol-1。
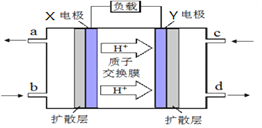
Ⅱ.甲醇质子交换膜燃料电池的工作原理如上图所示,写出X电极的电极反应式_______________。
(3) 下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式: __________________。