题目内容
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3—)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
| A.原混合溶液中c(K+)为2 mol·L-1 |
| B.上述电解过程中共转移6 mol电子 |
| C.电解得到的Cu的物质的量为0.5 mol |
| D.电解后溶液中c(H+)为2 mol·L-1 |
A
解析

练习册系列答案
相关题目
电化学与现代人的生活密切相关,具备一定的电化学知识对于方便生产生活有很重要的意义。某同学为了研究电化学原理设计了如下图所示的装置: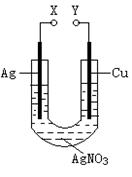
下列说法中不正确的是
| A.X和Y不连接时,铜棒上会有金属银析出 |
| B.X和Y用导线连接时,银棒上发生的反应为Ag++e—=Ag |
| C.若X接直流电源的正极Y接负极,Ag+向银电极移动 |
| D.无论X和Y是否连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色 |
汽车等机动车辆的启动电源常用铅蓄电池,放电时的电池反应如下:
PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb+SO42--2e-=PbSO4 |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反
应可表示为2H2+O2=2H2O,下列有关说法正确的是( )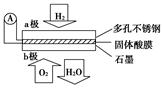
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为O2+2H2O+4e-=4OH- |
| C.每转移0.1 mol电子,消耗1.12 L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |
如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细。下表所列M、N、P物质中,可以组合成该装置的是( )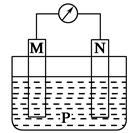
| 选项号 | M | N | P |
| A | 锌 | 铜 | 稀硫酸 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
甲烷燃料电池,分别选择H2SO4溶液和NaOH溶液做电解质溶液,下列有关说法正确的是( )
| A.总反应式都为CH4+2O2=CO2+2H2O |
| B.H2SO4和NaOH的物质的量都不变,但浓度都减小 |
| C.若用H2SO4溶液做电解质溶液,负极反应式为CH4-4e-+H2O=CO2+4H+ |
| D.若用NaOH溶液做电解质溶液,正极反应式为O2+2H2O+4e-=4OH- |
下列电化学实验装置正确的是( )
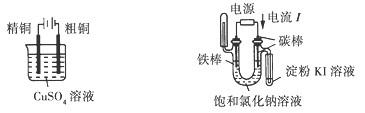 | |
| A.电解精炼铜 | B.验证电解饱和氯化钠溶液 (含酚酞)的产物 |
 | |
| C.在铁制品上镀铜 | D .构成原电池 |
目前人们掌握了可充电锌—空气电池技术,使这种电池有了更广泛的用途。这种电池使用特殊技术吸附空气中的氧,以苛性钠溶液为电解质,电池放电时的总反应为2Zn+O2=2ZnO,下列判断正确的是( )
| A.放电时,OH-向负极方向移动 |
| B.放电时,正极反应式为Zn+2OH--2e-=ZnO+H2O |
| C.充电时,Zn发生氧化反应 |
| D.充电时,阴极反应为O2+2H2O+4e-=4OH- |
用酸性氢氧燃料电池为电源进行电解的实验装置图如图所示,下列说法中正确的是( )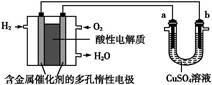
| A.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH- |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |