题目内容
常温时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.饱和碳酸钠溶液中:c(Na+)= 2c(CO32-)+ 2c(HCO3-)+2c(H2CO3) |
| B.pH=2的醋酸中:c(H+)=0.02mol?L-1 |
| C.0.1 mol?L-1氯化铵溶液中:c(H+)> c(OH-)> c(Cl-)> c(NH4+) |
| D.pH=12的NaOH溶液与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+) = c(NH4+) |
A
解析试题分析:A、在碳酸钠溶液中,根据物料守恒,钠元素的浓度是碳元素的2倍,碳元素的存在形式有CO32-、HCO3-、H2CO3,正确;B、pH=2的醋酸中:c(H+)=0.01mol?L-1,错误;C、氯化铵溶液呈酸性,离子浓度最大的是不水解的离子Cl-,错误;D、二者的体积、浓度均相同,恰好完全反应,反应后的溶液呈碱性,根据电荷守恒,所以有c(Na+)>c(NH4+),错误,答案选A。
考点:考查溶液中离子浓度的大小关系,根据pH计算离子浓度

练习册系列答案
相关题目
一定温度下,将0.1molAgCl加入1L 0.1mol·L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是
A.沉淀转化反应2AgCl(s)+ CO32-(aq) Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1 Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1 |
| B.约有2×10-5mol AgCl溶解 |
| C.反应后溶液中的:c(Na+)>c (Cl-) >c (CO32-) >c (OH-) >c (H+) |
| D.反应后溶液中的:c(Na+)+ c (H+)+ c (Ag+)="2" c (CO32-)+ c (HCO3-)+ c (Cl-)+ c (OH-) |
常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是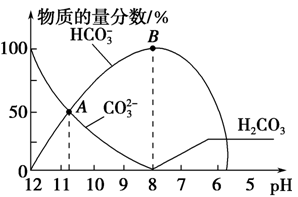
| A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+ c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B.当溶液的pH为7时,溶液的总体积为20 ml |
| C.在B点所示的溶液中,浓度最大的阳离子是Na+ |
| D.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) |
下列说法不正确的是
| A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| B.加热、蒸发MgCl2饱和溶液可得无水MgCl2晶体 |
| C.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
| D.室温下,c(NH4+)相等的(NH4)2SO4、NH4HCO3、NH4Cl溶液中:c(NH4)2SO4<c(NH4Cl)<c(NH4HCO3) |
在25 ℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
| A.25 ℃时,CuS的溶解度大于ZnS的溶解度 |
| B.25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1 |
| C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成 |
| D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂 |
有关AgCl的沉淀溶解平衡的说法正确的是
| A.AgCl沉淀生成和溶解同时在不断进行,且速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.用等体积的蒸馏水和0.01mol·L-1的盐酸洗涤AgCl沉淀,用水洗涤造成的AgCl的损失小于用稀盐酸洗涤的损失量。 |
| D.向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化 |
下列说法正确的是
| A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 |
| B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 |
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(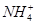 )/c(NH3·H2O)的值增大 )/c(NH3·H2O)的值增大 |
| D.室温下,CH3COOH的KW=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等 |
能使水的电离平衡右移,且水溶液显碱性的离子是( )
| A.H+ | B.OH- | C.Al3+ | D.HCO3- |
某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则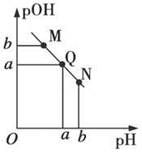
| A.M点所示溶液的导电能力强于Q点 |
| B.N点所示溶液中c(CH3COO-)>c(Na+) |
| C.M点和N点所示溶液中水的电离程度相同 |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |