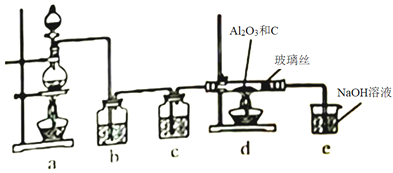
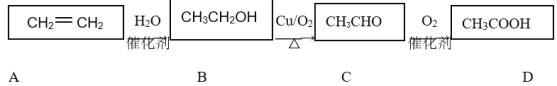
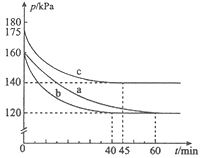
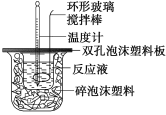
题目内容
【题目】(1)K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O氧化剂是______,氧化产物与还原产物的物质的量之比为_______。
(2)配平下列反应方程式
①____S +____HNO3——_____H2SO4 +______NO2↑ +____H2O
② 若6.4g单质硫参加反应时,反应过程中转移电子的物质的量为______。
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为_____ L。
【答案】K2Cr2O7 3:2 1 6 1 6 2 1.2mol 22.4
【解析】
(1)化合价升高的元素被氧化,化合价降低的元素所在的反应物是氧化剂,对应的产物是还原产物,化合价升高的元素所在的反应物是还原剂,根据反应中发生化合价变化的量来判断氧化剂与还原剂的物质的量之比;
(2)氧化还原反应中,元素化合价升高值等于元素化合价降低值,根据电子守恒来配平方程式;
(3)被氧化的氨气生成氮气,根据方程式计算生成氨气的物质的量,再根据氮原子守恒计算被氧化的氨气的物质的量,根据V=nVm计算被氧化氨气的体积。
(1)在K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O反应中,氯元素化合价升高,所以氯元素被氧化,HCl是还原剂,其产物Cl2为氧化产物,铬元素化合价降低,所以K2Cr2O7是氧化剂,对应的产物CrCl3是还原产物,则氧化产物与还原产物的物质的量之比为3:2;
(2)①该反应中元素的化合价变化如下:S→H2SO4,S元素的化合价由0价→+6价,一个S失去6个电子;HNO3→NO2,N元素的化合价由+5价→+4价,得到1e-;化合价升高数=化合价降低数,所以得失电子的最小公倍数为6,则该反应为:S +6HNO3=H2SO4 +6NO2↑ +2H2O;
②6.4g硫的物质的量为![]() =0.2mol,则6.4g单质硫参加反应时,反应过程中转移电子的物质的量为0.2mol×6=1.2mol;
=0.2mol,则6.4g单质硫参加反应时,反应过程中转移电子的物质的量为0.2mol×6=1.2mol;
(3)被氧化的氨气生成氮气,根据方程式可知生成氮气的物质的量为1.5mol×![]() =0.5mol,根据氮原子守恒可知被氧化的氨气的物质的量为0.5mol×2=1mol,故被氧化氨气的体积为1mol×22.4L/mol=22.4L。
=0.5mol,根据氮原子守恒可知被氧化的氨气的物质的量为0.5mol×2=1mol,故被氧化氨气的体积为1mol×22.4L/mol=22.4L。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案