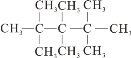题目内容
【题目】下列离子方程式中,正确的是
A.小苏打溶液与少量澄清石灰水混合:Ca2++OH-+![]() =CaCO3↓+H2O
=CaCO3↓+H2O
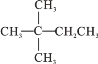
B.AlCl3溶液中加入足量的氨水:Al3++4OH-=![]() +2H2O
+2H2O
C.将氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+
D.钠与水反应:2Na + 2H2O = 2Na++ 2OH-+ H2↑
【答案】D
【解析】
A.小苏打溶液与少量澄清石灰水混合,OH-完全反应,离子方程式:Ca2++2OH-+2![]() =CaCO3↓+2H2O+CO
=CaCO3↓+2H2O+CO![]() ,故A错误;
,故A错误;
B.一水合氨为弱碱,不能写成离子,且不与氢氧化铝反应,离子方程式为Al3++3NH3H2O=A1(OH)3↓+3NH![]() ,故B错误;
,故B错误;
C.HClO为弱酸,不能写成离子,正确离子方程式为Cl2+H2OCl-+HClO+H+,故C错误;
D.Na与水反应生成NaOH和氢气,离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故D正确;
故答案为D。

练习册系列答案
相关题目
【题目】一定温度下,向2.0L恒容密闭容器中充入2molSO2和1molO2,发生反应为:2SO2(g)+O2(g) ![]() 2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
A.反应在前2 s的平均速率υ(O2)=0.4 mol·L1·s1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2) 增大