题目内容
【题目】室温下,用相同浓度的NaOH溶液分别滴定浓度均为![]()
![]() 的三种酸
的三种酸![]() 、HB和
、HB和![]() 溶液,滴定的曲线如图所示。下列判断不正确的是
溶液,滴定的曲线如图所示。下列判断不正确的是![]()
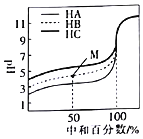
A.三种酸的电离平衡常数:![]()
B.滴定至M点时,溶液中:![]()
![]()
C.![]() 时,三种溶液中:
时,三种溶液中:![]()
![]()
D.当中和百分数达到![]() 时,三种溶液中:
时,三种溶液中:![]()
【答案】D
【解析】
![]() 相同物质的量浓度的一元酸,酸的pH越小,氢离子浓度越大,说明酸的电离程度越大,则该酸的酸性越强,其电离平衡常数越大,根据图知,未加NaOH溶液时,pH:
相同物质的量浓度的一元酸,酸的pH越小,氢离子浓度越大,说明酸的电离程度越大,则该酸的酸性越强,其电离平衡常数越大,根据图知,未加NaOH溶液时,pH:![]() ,说明酸的电离程度
,说明酸的电离程度![]() ,则
,则![]() ,故A正确;
,故A正确;
B.中和![]() 即M点,溶液中溶质为等物质的量浓度的酸
即M点,溶液中溶质为等物质的量浓度的酸![]() 和盐
和盐![]() ,由图可知溶液呈酸性,则
,由图可知溶液呈酸性,则![]() ,且酸的电离程度大于酸根离子水解程度,
,且酸的电离程度大于酸根离子水解程度,
①![]() 完全电离:
完全电离:![]() ,这一步的
,这一步的![]() ,
,
②![]() 少部分电离:
少部分电离:![]() ,则
,则![]() ,
,
③![]() 少部分水解:
少部分水解:![]() ,
,
由于酸的电离程度大于盐的水解程度,则HB电离产生的![]() 相对NaB水解消耗的
相对NaB水解消耗的![]() 多,所以
多,所以![]() ,由于HB电离消耗得多,水解生成的HB少,
,由于HB电离消耗得多,水解生成的HB少,
所以![]() ,则
,则![]() ,故B正确;
,故B正确;
C.当![]() 时,根据电荷守恒三种溶液中离子浓度关系为:
时,根据电荷守恒三种溶液中离子浓度关系为:
![]() ,由于
,由于![]() ,所以
,所以![]() ,
,
![]() ,由于
,由于![]() ,所以
,所以![]() ,
,
![]() ,由于
,由于![]() ,所以
,所以![]() ,
,
由于三种酸根的水解程度不同,则溶液呈中性时所消耗的氢氧化钠的体积不相同,则三种溶液中钠离子浓度不同,![]() ,
,![]() ,
,![]() 也不同,
也不同,![]() ,故C正确;
,故C正确;
D.恰好中和时,三种溶液所消耗的氢氧化钠体积相同,生成三种盐的起始浓度相同,盐类水解越弱越水解,则水解程度:![]() ,则溶液中酸浓度大小为:
,则溶液中酸浓度大小为:![]() ,故D错误,
,故D错误,
答案选D。

练习册系列答案
相关题目
【题目】实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )
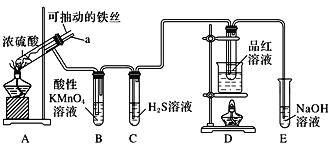
A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性 |
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe3+ |
C.装置D中品红溶液褪色可以验证SO2的漂白性 |
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸 |

