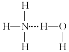题目内容
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A.一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA
B.完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA
C.100g 98%的浓硫酸中含氧原子个数为4NA
D.1L 0.1 mol/L的Na2S溶液中S2-和HS-的总数为0.1NA
【答案】B
【解析】
A、N2和H2生成NH3是可逆反应,1molN2和3molH2充分反应生成NH3小于2mol所以生成物中的N—H键数目小于6NA,A项错误;
B、CH3CH20H+3O2=2CO2+3H2O,C2H4+3O2=2CO2+2H2O,1.5mol气体反应转移电子都是1.8mol即18NA,所以完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA,B项错误;
C、l00g、98%的浓硫酸中m(H2SO4)= l00g×98%=98g,n=![]() =1mol,其中N(O)=4NA,但是溶液中还有水,加上水中的O就大于4NA,C项错误;
=1mol,其中N(O)=4NA,但是溶液中还有水,加上水中的O就大于4NA,C项错误;
D、因为Na2S溶液中S2-会发生水解生成HS一和H2S,根据S原子守恒得n(S2-)+n(HS-)+n(H2S)= 1L×0.1 mol/L=1mol,所以S2-、HS-和H2S的总数为0.1NA,D项错误;
故答案选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目