题目内容
【题目】用水稀释0.1![]() 氨水,溶液中随着水量的增加而增大的是( )
氨水,溶液中随着水量的增加而增大的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
【答案】D
【解析】已知氨水中的电离平衡常数Kb=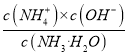 ,水的离子积常数Kw=c(H+)×c(OH-),且二者都只随温度的改变而变化,所以A的表达式是
,水的离子积常数Kw=c(H+)×c(OH-),且二者都只随温度的改变而变化,所以A的表达式是![]() 整理所得,也是常数,故A错误;B、对于电离平衡NH3·H2O
整理所得,也是常数,故A错误;B、对于电离平衡NH3·H2O![]() NH4++OH-,随着加水稀释,溶液体积增大,使c(NH4+)和c(OH—)减小,而B的表达式=Kb×c(NH4+)×c(OH—),所以B的表达式是减小的,则B错误;C、c(OH—)·c(H+)=Kw,是个常数,则C错误;D、由于加入稀释,使c(OH—)减小,而Kw不变,所以c(H+)增大,则
NH4++OH-,随着加水稀释,溶液体积增大,使c(NH4+)和c(OH—)减小,而B的表达式=Kb×c(NH4+)×c(OH—),所以B的表达式是减小的,则B错误;C、c(OH—)·c(H+)=Kw,是个常数,则C错误;D、由于加入稀释,使c(OH—)减小,而Kw不变,所以c(H+)增大,则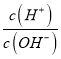 是变大的,故D正确。本题正确答案为D。
是变大的,故D正确。本题正确答案为D。

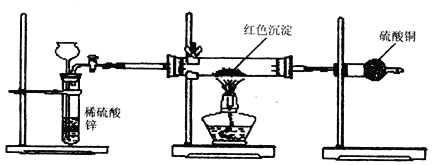
【题目】现有含FeCl2杂质的CuCl2·2H2O晶体,为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
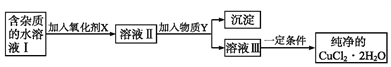
已知:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)得到溶液II,需加入氧化剂X, 加入氧化剂X的目的是____________________________。最适合作氧化剂X的是_________(填编号)。A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入试剂Y,调节溶液的pH范围是__________。下列中不适合作试剂Y的是_______(填编号)。
A.CuO B.Cu(OH)2 C.CuCO3 D.氨水
(3)由溶液Ⅲ得到CuCl2·2H2O晶体的操作是________________________________,过滤,洗涤,干燥。
(4)已知:某难溶物M(OH)3的Ksp=1×10-35 。若要使M3+沉淀完全,溶液的pH最小为______。