题目内容
2.X、Y、Z、W为原子序数依次增大的四种短周期主族元素,其原子核外L电子层的电子数分别为0、5、6、8,它们的最外层电子数之和为17,下列说法不正确的是( )| A. | 原子半径:W>Y>Z>X | |
| B. | 最高价氧化物对应水化物的酸性:Y>W | |
| C. | 单质沸点W>Z | |
| D. | X、Y、Z不能存在与同一离子化合物中 |
分析 X、Y、Z、W均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、6、8,则X是H元素,Y是N元素,Z为O元素,W为第三周期元素;它们的最外层电子数之和为17,X最外层电子数是1,Y最外层电子数是5,Z最外层电子数是6,则W的最外层电子数为5,则W是P元素,
A.电子层越多半径越大,电子层相同时,原子序数越大,半径越小;
B.同主族从上到下最高价氧化物对应水化物的酸性减弱;
C.根据物质常温下的状态分析;
D.X、Y、Z可以形成硝酸铵.
解答 解:X、Y、Z、W均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、6、8,则X是H元素,Y是N元素,Z为O元素,W为第三周期元素;它们的最外层电子数之和为17,X最外层电子数是1,Y最外层电子数是5,Z最外层电子数是6,则W的最外层电子数为5,则W是P元素,
A.电子层越多半径越大,电子层相同时,原子序数越大,半径越小,则原子半径:P>N>O>H,即W>Y>Z>X,故A正确;
B.同主族从上到下最高价氧化物对应水化物的酸性减弱,则硝酸的酸性大于磷酸,即最高价氧化物对应水化物的酸性:Y>W,故B正确;
C.常温下,P的单质为固体,O的单质为气体,则单质沸点W>Z,故C正确;
D.X、Y、Z可以形成硝酸铵,所以X、Y、Z能存在于同一离子化合物中,故D错误.
故选D.
点评 本题考查原子结构和元素性质,涉及离子化合物判断、酸性强弱判断、物质熔沸点高低判断、元素周期律等知识点,正确判断元素是解本题关键,结合物质的结构性质解答.

练习册系列答案
相关题目
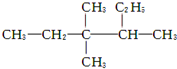 的名称为3,3,4-三甲基己烷
的名称为3,3,4-三甲基己烷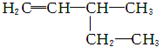 的名称为3-甲基-1-戊烯
的名称为3-甲基-1-戊烯
 NH3•H2O+H+(用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH 溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)=c(NH3•H2O).(填“>”、“<”或“=”)
NH3•H2O+H+(用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH 溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)=c(NH3•H2O).(填“>”、“<”或“=”)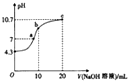 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体. .该元素的原子序数为21,该元素是金属元素(填“金属”或“非金属”),形成的单质为金属晶体.
.该元素的原子序数为21,该元素是金属元素(填“金属”或“非金属”),形成的单质为金属晶体. ,C元素最高价氧化物对应的水化物的电子式
,C元素最高价氧化物对应的水化物的电子式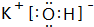 .
.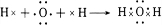 .
. 和足量氢氧化钠溶液反应:
和足量氢氧化钠溶液反应: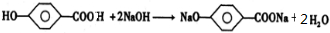
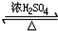 CH3OOCCOOCH3+2H2O
CH3OOCCOOCH3+2H2O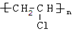 .
.