题目内容
13.已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,下列说法不正确的是( )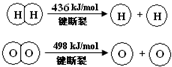
| A. | 该反应原理可用于设计氢氧燃料电池 | |
| B. | 破坏1 mol H-O键需要的能量是463.4 kJ | |
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.8 kJ/mol | |
| D. | H2(g)中的H-H键能比H2O(g)中的H-O键能大 |
分析 A.根据氧化还原反应可以设计成原电池反应;
B.根据反应热等于反应物的总键能-生成物的总键能来求解;
C.根据反应热与物质的量成正比以及反应逆向进行,反应热大小不变,符号相反;
D.根据键能越大越牢固.
解答 解:A.2H2(g)+O2(g)?2H2O是氧化还原反应,可以设计氢氧燃料电池,故A正确;
B.2H2(g)+O2(g)?2H2O(g)的反应热△H=反应物的总键能-生成物的总键能=436kJ•mol-1×2+498kJ•mol-1-4×XkJ•mol-1=-483.6kJ/mol,解得X=463.4kJ•mol-1,所以破坏1molH-O键需要的能量是463.4kJ,故B正确;
C.反应热与物质的量成正比,所以H2(g)+$\frac{1}{2}$O2(g)?H2O(g)△H=-241.8kJ/mol,反应逆向进行,反应热大小不变,符号相反,所以H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+241.8kJ/mol,故C正确;
D.H2(g)中的H-H键键能为436kJ•mol-1,H2O(g)中的H-O键键为463.4kJ•mol-1,所以H2O(g)中的H-O键比H2(g)中的H-H键大,故D错误;
故选:D.
点评 本题主要考查了反应热的计算,难度不大,需要注意的是反应热等于反应物的总键能-生成物的总键能,键能越大越牢固.

练习册系列答案
相关题目
3.下列反应可以设计成原电池的是( )
| A. | CH4+2O2═CO2+2H2O | B. | NaOH+HCl═NaCl+H2O | ||
| C. | Zn+CuSO4═Cu+ZnSO4 | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
4.下列为某同学利用所学的相关数据进行的推测,其中不正确的是( )
| A. | 根据电解质的电离程度数据推测电解质溶液的导电性 | |
| B. | 用分子所具有能量数据分析分子的稳定性 | |
| C. | 应用固体溶解度数据判断某些复分解反应能否进行 | |
| D. | 利用电解质的电离常数判断某些酸式盐的水溶液的酸碱性 |
8.下列说法中,正确的是( )
| A. | 活化分子间的碰撞一定是有效碰撞 | |
| B. | 其他条件相同时,增大反应物浓度,反应物中活化分子的百分数增加 | |
| C. | 焓变和熵变都与反应的自发性有关,它们都能独立地作为自发性的判据 | |
| D. | 常温下,FeCl3溶液中由水电离出的c (H+)一定大于1×10-7mol/L |
18.海带中含碘元素,从海带中提取碘有如下步骤:①将海带焙烧成灰后加水搅拌并煮沸3分钟;②冷却后进行操作1;③在滤液中滴加稀硫酸和足量双氧水(H2O2);④加CCl4振荡;⑤用分液漏斗分液.操作1是( )
| A. | 结晶 | B. | 萃取 | C. | 过滤 | D. | 蒸馏 |
5.以下比较中,正确的是( )
| A. | 微粒半径:O2-<F-<Na+<Li+ | |
| B. | 晶格能由大到小:NaI>NaBr>NaCl>NaF | |
| C. | 分子中的键角:CH4>H2O>CO2 | |
| D. | 共价键的键能:C-C>C-Si>Si-Si |
2.核糖是合成核酸的重要原料,结构简式为:CH2OH-CHOH-CHOH-CHOH-CHO.下列关于核糖的叙述不正确的是( )
| A. | 与葡萄糖互为同分异构体 | |
| B. | 既可以与氧气反应,也可以与新制氢氧化铜反应 | |
| C. | 1个核糖分子可以与4个乙酸分子发生取代反应 | |
| D. | 不能使紫色石蕊试液变红 |
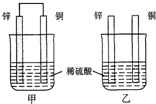 现有如下两个反应:A.Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O B.Zn+H2SO4═ZnSO4+H2↑
现有如下两个反应:A.Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O B.Zn+H2SO4═ZnSO4+H2↑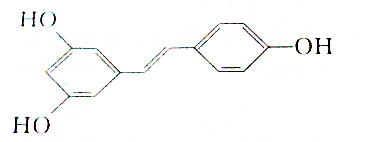 ,则白藜芦醇的分子式为C14H12O3.
,则白藜芦醇的分子式为C14H12O3.