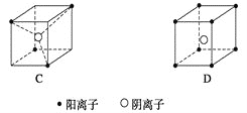
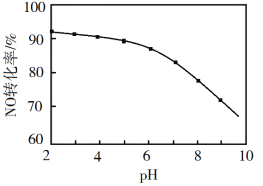
题目内容
【题目】氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是______________。
②已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
iii为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用__________反应的ΔH。
③反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是________________(选填字母序号)。
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
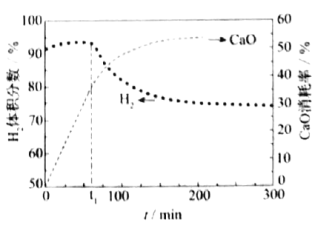
④用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如下图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率_______(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方程式解释原因:____________________________。
(2)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
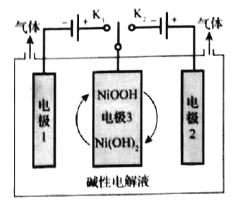
①制H2时,连接_______________。
产生H2的电极反应式是_______________。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用:________________________。
【答案】CH4 + 2H2O= 4H2 + CO2 C(s)+CO2(g)=2CO(g) abc 降低 H2体积分数在t1之后较少,结合CaO+H2O=Ca(OH)2可知水蒸气浓度较小,反应器内反应逆向反应,氧化钙很难和CO2反应,因而失效 K1 2H2O+2e-=H2↑+2OH- 连接K1或K2时,电极3分别作为阳极材料和阴极材料,并且NiOOH和Ni(OH)2相互转化提供电子转移
【解析】
(1)①由于生成物为H2和CO2,其物质的量之比为4:1,反应物是甲烷和水蒸气,因而反应方程式为CH4 + 2H2O= 4H2 + CO2;
②ⅰ-ⅱ可得CH4(g)+CO2(g)=2CO(g)+2H2(g),设为ⅳ,用ⅳ-ⅲ可得C(s)+CO2(g)=2CO(g),因为还需利用C(s)+CO2(g)=2CO(g)反应的焓变;
③初始反应n(H2O):n(CH4)=2:1,说明加入的水蒸气过量,又反应器中反应都存在一定可逆性,根据反应ⅰ知水蒸气浓度越大,甲烷的转化率越高,a正确;根据反应ⅱ知水蒸气浓度越大,CO的转化率越高,b正确;ⅰ和ⅱ产生氢气,使得氢气浓度变大,抑制反应ⅲ,积炭生成量减少,c正确;
④t1时CaO消耗率曲线斜率减小,因而单位时间内CaO的消耗率降低,H2体积分数在t1之后较少,结合CaO+H2O=Ca(OH)2可知水蒸气浓度较小,反应器内反应逆向反应,氧化钙很难和CO2反应,因而失效
(2)①电极生成H2时,根据电极放电规律可知H+得到电子变为氢气,因而电极须连接负极,因而制H2时,连接K1,该电池在碱性溶液中,由H2O提供H+,电极反应式为2H2O+2e-=H2↑+2OH-;
③电极3上NiOOH和Ni(OH)2相互转化,其反应式为NiOOH+e-+H2ONi(OH)2+OH-,当连接K1时,Ni(OH)2失去电子变为NiOOH,当连接K2时,NiOOH得到电子变为Ni(OH)2,因而作用是连接K1或K2时,电极3分别作为阳极材料和阴极材料,并且NiOOH和Ni(OH)2相互转化提供电子转移。

【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________________________。
(2)②和③气态氢化物稳定性的大小顺序:___________(填化学式)。
(3)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________(填化学式),它属于________(填“共价化合物”或“离子化合物”)。
(5)①④⑩三种元素的原子能形成原子数目比为1∶1∶1的共价化合物,它的电子式为________。
(6)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是________(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性