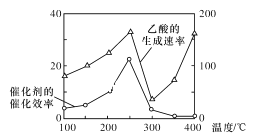
题目内容
【题目】下列说法错误的是
A.在1个CsCl晶胞中含有1个Cs+
B.SO2在水中的溶解度比CO2在水中的溶解度要大
C.X、Y元素同周期,且电负性X>Y,第一电离能可能Y大于X
D.根据电子排布的特点,Cu和Ga在周期表中都属于d区
【答案】D
【解析】
A.氯化铯晶体晶胞属于体心立方堆积,结构如图: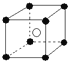 ,Cs+位于该晶胞的体心;而Cl位于该晶胞的顶点,晶胞中铯离子个数=1,氯离子个数=
,Cs+位于该晶胞的体心;而Cl位于该晶胞的顶点,晶胞中铯离子个数=1,氯离子个数=![]() ×8=1,故A正确;
×8=1,故A正确;
B.SO2属于极性分子,CO2属于非极性分子,根据相似相溶原理极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂,水为极性溶剂,所以SO2在水中的溶解度比CO2在水中的溶解度要大,故B正确;
C.X、Y元素同周期,且电负性X>Y,则非金属性X>Y,一般非金属性强的,其第一电离能大,电负性X>Y,则第一电离能可能X>Y,特殊情况如最外层半充满或全充满结构的如:P的电负性小于S,P的最外层电子排布为半充满,结构较为稳定,第一电离能P大于S,所以第一电离能可能Y>X,故C正确;
D.Cu属于第IB族元素,在周期表中位于ds区,Ga属于第IIIA主族,在周期表中位于p区,故D错误;
答案选D。

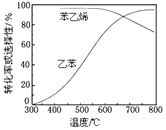
【题目】(一)某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验:利用如图装置可以验证元素的非金属性的变化规律。
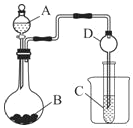
(1)图中:A装置名称是___,干燥管D的作用是___。
(2)实验室中现有药品Na2S、KMnO4、MnO2、浓盐酸,请从中选择合适药品设计实验验证氯的非金属性大于硫,烧瓶中发生反应的离子方程式为___。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2
装置A、C中所选试剂分别为__(填序号);能说明酸性H2CO3>H2SiO3的实验现象是__。
(二)四种短周期元素W、X、Y、Z,原子序数依次增大,请回答下列问题。
W | X | Y | Z | |
结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应 呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小,它的最高价氧化物为两性氧化物 | 最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于___族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是___(填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是___(填序号)。
a.自然界中的含量
b.单质与酸反应时失去的电子数
c.单质与水反应的难易程度
d.最高价氧化物对应水化物的碱性
②从原子结构的角度解释X的金属性强于Y的原因:___。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是__。
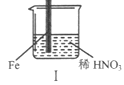
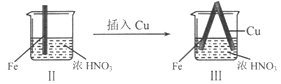
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【题目】向盛有不同试剂的试管b中分别滴加适量0.1mol/L FeCl3 溶液,下列对b中现象及解释正确的是
实验 | b中物质 | b中现象 | 结论或解释 | |
| A | Mg(OH)2 悬浊液 | 有红棕色胶体产生 | 发生反应: Fe3++3OH-= Fe(OH)3(胶体) |
B | Cu粉 | 溶液变蓝,试管底部有固体 | 溶液变蓝的原因是: 3Cu+2Fe3+ =2Fe+3Cu2+ | |
C | 5%H2O2溶液 | 有气泡生成 | 该气体为氯气,双氧水有强氧化性氧化Cl- 产生Cl2 | |
D | 饱和NaHCO3溶液 | 有气泡生成,且试管底部有固体 | 发生反应: Fe3++3HCO3-= Fe(OH)3 +3CO2 |
A. A B. B C. C D. D