题目内容
15.相同温度下两种H3PO4溶液a和b浓度分别为0.3mol/L和0.1mol/L,则a和b溶液中H+浓度之比为( )| A. | 3 | B. | 大于3 | C. | 小于3 | D. | 不能确定 |
分析 H3PO4存在电离平衡,将其加水稀释3倍,因电离平衡正向移动,c(H+)大于原来溶液中c(H+)的13,据此分析.
解答 解:H3PO4存在电离平衡,将其加水稀释3倍,因电离平衡正向移动,c(H+)大于原来溶液中c(H+)的13,所以两种H3PO4溶液a和b浓度分别为0.3mol/L和0.1mol/L,则a和b溶液中H+浓度之比为小于3,故选C.
点评 本题考查了弱酸存在电离平衡且其浓度越小电离程度越大,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
5.下列各组离子一定能大量共存的是( )
| A. | 在pH=1的溶液中:Na+、NO3-、I-、K+ | |
| B. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl- | |
| C. | 常温下水电离的c(OH-)=1×10-13mol•L-1的溶液中:NH4+、HCO3-、SO42-、Cl- | |
| D. | 含有HCO3-的溶液中:K+、NH4+、NO3-、Ca2+ |
6.在某无色透明的碱性溶液中,能大量共存的离子组是( )
| A. | Na+、K+、SO42-、HCO3- | B. | Ba2+、K+、Cl-、NO3- | ||
| C. | Cu2+、K+、Cl-、NO3- | D. | Fe3+、K+、SO42-、Cl- |
3.下列各组物质,互为同系物的是( )
| A. | CH3-CH=CH2与  | B. |  与 与 | ||
| C. | 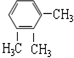 与 与 | D. | CH3CH2Cl 与CH3CHCl-CH2Cl |
20.一定条件下,体积为1L的密闭容器中,2mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A. | 若增大压强,则混合气体的平均分子量减小 | |
| B. | 将容器体积变为0.5 L,Z的平衡浓度变为原来的2倍 | |
| C. | 以X浓度变化表示的反应速率为0.01 mol/(L•s) | |
| D. | 保持体积不变,向其中充入1 mol He气体,平衡右移 |

 ,在该反应中,当有0.1mol电子发生转移时,生成标准状况氯气的体积为1.12L.
,在该反应中,当有0.1mol电子发生转移时,生成标准状况氯气的体积为1.12L.
 +Br2
+Br2 +HBr.
+HBr.