题目内容
17.常温下,0.1mol•L-1HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=108,现取0.1mol•L-1HA溶液与pH=13的NaOH溶液等体积混合(忽略混合后溶液体积的变化).试回答下列问题:(1)混合液呈碱(填“酸”“中”或“碱”)性,理由(用离子方程式表示)A-+H2O?HA+OH-.
(2)混合溶液中由水电离出的c(H+)大于(填“大于”“小于”或“等于”)0.1mol•L-1NaOH溶液中由水电离出的c(H+).
分析 (1)常温下,0.1mol•L-1HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=108,c(H+).c(OH-)=10-14,所以该溶液中c(H+)=10-3mol/L<0.1mol/L,则HA是弱酸,常温下pH=13的NaOH溶液中c(OH-)=0.1mol/L,物质的量浓度、体积相同的HA和NaOH恰好反应生成NaA,NaA是强碱弱酸盐,溶液呈碱性;
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离.
解答 解:(1)常温下,0.1mol•L-1HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=108,c(H+).c(OH-)=10-14,所以该溶液中c(H+)=10-3mol/L<0.1mol/L,则HA是弱酸,常温下pH=13的NaOH溶液中c(OH-)=0.1mol/L,物质的量浓度、体积相同的HA和NaOH恰好反应生成NaA,NaA是强碱弱酸盐,弱酸根离子水解溶液呈碱性,水解离子方程式为A-+H2O?HA+OH-,
故答案为:碱;A-+H2O?HA+OH-;
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,NaA促进水电离、NaOH抑制水电离,所以混合溶液中由水电离出的c(H+)大于0.1mol•L-1NaOH溶液中由水电离出的c(H+),
故答案为:大于.
点评 本题考查酸碱混合溶液定性判断,为高频考点,涉及盐类水解、水的电离,正确判断HA的强弱是解本题关键,题目难度不大.

练习册系列答案
相关题目
8.在强酸性溶液,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+ K+ OH- Cl- | B. | Na+ Fe3+ SO42- NO3- | ||
| C. | Mg2+ Na+ SO42- Cl- | D. | Ba2+ HCO3- NO3- K+ |
1.二氧化碳与氢气催化合成甲醇,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
(1)已知:
计算上述反应的△H=-46kJ•mol-1.
(2)一定条件下,将n(CO2):n(H2)=1:1的混合气充入恒温恒容密闭容器中,下列事实可以说明该反应已达到平衡的是BCEF(填选项字母)
A、容器内气体密度保持不变 B、CO2的体积分数保持不变
C、H2O(g)与CO2(g)的生成速率之比为1:1 D、该反应的平衡常数保持不变
E、混合气体的平均相对分子质量不变 F、容器中压强保持不变
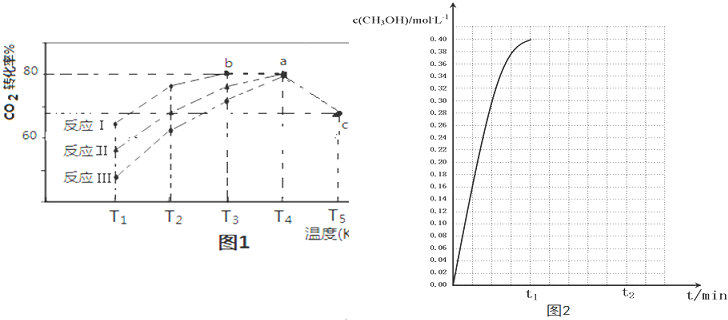
(3)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,在不同催化剂作用下的反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制图1:
(T5时,图1中C点转化率为66.67%,即转化了$\frac{2}{3}$)
①催化剂效果最佳的反应是反应Ⅰ(填“反应Ⅰ”、“反应Ⅱ”、“反应Ⅲ”)
②T3的b点v(正)>v(逆).(填“>”“<”“=”)
③T4的a点转化率比T5的c点高原因是该反应为放热反应,温度升高,平衡逆向移动.
④在温度为T5时,该反应的平衡常数K=$\frac{100}{27}$.
⑤在温度为T5时,CH3OH的浓度随时间变化的趋势如图2所示.
当时间到达t1时,将生成的甲醇和水同时除去,并维持该温度,在t2时达到平衡.
请在图2 中画出t1时刻后CH3OH的浓度变化总趋势曲线.
(1)已知:
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| 键能(KJ•mol-1) | 436 | 326 | 803 | 464 | 414 |
(2)一定条件下,将n(CO2):n(H2)=1:1的混合气充入恒温恒容密闭容器中,下列事实可以说明该反应已达到平衡的是BCEF(填选项字母)
A、容器内气体密度保持不变 B、CO2的体积分数保持不变
C、H2O(g)与CO2(g)的生成速率之比为1:1 D、该反应的平衡常数保持不变
E、混合气体的平均相对分子质量不变 F、容器中压强保持不变
(3)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,在不同催化剂作用下的反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制图1:
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |
①催化剂效果最佳的反应是反应Ⅰ(填“反应Ⅰ”、“反应Ⅱ”、“反应Ⅲ”)
②T3的b点v(正)>v(逆).(填“>”“<”“=”)
③T4的a点转化率比T5的c点高原因是该反应为放热反应,温度升高,平衡逆向移动.
④在温度为T5时,该反应的平衡常数K=$\frac{100}{27}$.
⑤在温度为T5时,CH3OH的浓度随时间变化的趋势如图2所示.
当时间到达t1时,将生成的甲醇和水同时除去,并维持该温度,在t2时达到平衡.
请在图2 中画出t1时刻后CH3OH的浓度变化总趋势曲线.

8.下列描述及热化学方程式均正确的是( )
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)═6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ•mol-1 |
5. 为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4+H2?CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4+H2?CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.
在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应).
(1)此反应在110℃时平衡常数为1.
(2)实验l中,CCl4的转化率A大于50%(填“大于”、“小于”或“等于”).
(3)实验3中,B的值D(选填序号).
A.等于50% B.大于50% C.小于50% D.从本题资料,无法判断
(4)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2mol•L-1和4mol•L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3,的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线).在图中的四条线中,表示H2起始浓度为2mol•L一1实验的消耗CCl4的百分率变化曲线是③(选填序号).
 为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4+H2?CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4+H2?CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应).
| 实验 序号 | 温度℃ | 初始CCl4浓度 (mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的平衡转化率 |
| 1 | 110 | 1 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
(2)实验l中,CCl4的转化率A大于50%(填“大于”、“小于”或“等于”).
(3)实验3中,B的值D(选填序号).
A.等于50% B.大于50% C.小于50% D.从本题资料,无法判断
(4)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2mol•L-1和4mol•L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3,的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线).在图中的四条线中,表示H2起始浓度为2mol•L一1实验的消耗CCl4的百分率变化曲线是③(选填序号).
6.在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g)═2AB3(g)△H<0,相关数据如下表所示:△H<0,相关数据如下表所示:
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1mol A2、3mol B2 | 2mol AB3 | 2mol AB3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时AB3的浓度/mol•L-1 | c甲 | c乙 | c丙 |
| 平衡时AB3的反应速率/mol•L-1•min-1 | v甲 | v乙 | v |
| A. | v甲=v丙 | B. | c乙>c甲 | C. | V甲>V丙 | D. | K乙<K丙 |




 .
.