题目内容
3.120℃时10mL某气态烃与过量氧气混合,完全燃烧后的产物通过浓硫酸后,再恢复到室温,气体体积减少了30mL,剩余气体再通过足量的NaOH溶液,体积又减少了30mL.该气态烃可能是( )| A. | C2H6 | B. | C3H8 | C. | C3H6 | D. | C3H4 |
分析 根据气态烃与过量的氧气反应的化学方程式:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,利用差量法计算出有机物分子中的H原子数;再把这些气体通过NaOH溶液气体体积,又减少了30mL,减少的气体为二氧化碳气体体积,据此可计算出该烃中含有C原子数,从而确定该烃的分子式.
解答 解:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O△V
1 1+$\frac{y}{4}$
10mL 30mL
则:1×30mL=10mL×(1+$\frac{y}{4}$),
解得:y=8,即:该有机物分子中含有8个H原子,
把反应后的气体通过NaOH溶液气体体积,又减少了30mL,减少的气体为二氧化碳,
相同条件下气体的体积之比等于物质的量之比,则该烃中含有C原子数为:$\frac{30mL}{10mL}$=3,
所以该有机物分子式为:C3H8,
故选B.
点评 本题考查有机物分子式的确定计算,题目难度中等,明确气体体积减少的实质为解答关键,注意掌握差量法、质量守恒定律在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
13.下列说法中错误的是( )
| A. | 铝制品表面有一层致密的氧化物薄膜,起保护作用 | |
| B. | 金属具有延展性,可以用来铸造某些机器部件 | |
| C. | 钠原子在氧化还原反应中失去1个电子,而铝原子失去3个电子,故钠的还原性弱于铝 | |
| D. | 钠可以保存在CCl4中 |
11.我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
则羊毛的编号为③,棉花的编号为②,涤纶的编号为①.
| 纤维编号 | ① | ② | ③ |
| 灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |
18.下列说法正确的是( )
| A. | 苯和乙烯均含有碳碳双键,均可使溴的CCl4溶液褪色 | |
| B. | 苯( )的一氯代物有一种,丙烷的一氯代物也有一种 )的一氯代物有一种,丙烷的一氯代物也有一种 | |
| C. | 乙醇和乙烯均可与酸性高锰酸钾发生反应 | |
| D. | 蔗糖和麦芽糖互为同分异构体,纤维素和淀粉也互为同分异构体 |
8.在强酸性溶液,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+ K+ OH- Cl- | B. | Na+ Fe3+ SO42- NO3- | ||
| C. | Mg2+ Na+ SO42- Cl- | D. | Ba2+ HCO3- NO3- K+ |
12.已知在25℃、101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量.表示辛烷燃烧热的热化学方程式正确的是( )
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-48.40kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2 (g)+9H2O(l)△H=-5517.60kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-5517.60kJ•mol-1 | |
| D. | 2C8H18(l)+25O2(g)═16CO2 (g)+18H2O(l)△H=-11035.20kJ•mol-1 |
 .该物质中几种元素的第一电离能由大到小的顺序是N>O>C>H,该物质的晶体中肯定不存在的作用力是d.
.该物质中几种元素的第一电离能由大到小的顺序是N>O>C>H,该物质的晶体中肯定不存在的作用力是d.
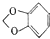
 (填结构简式).
(填结构简式).