题目内容
【题目】X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
(1) X、Y、Z的第一电离能从大到小的顺序是___________(用元素符号表示,下同)。
(2)写出W的价电子排布式_____________,W同周期的元素中,与W原子最外层电子数相等的元素还有____________。
(3)根据等电子体原理,可知化合物XZ的结构式是__________, YZ2-的VSEPR模型是___________。
(4) X、Y、Z的.简单氮化物的键角从大到小的顺序是_______(用化学式表示),原因是________________
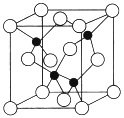
(5)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式___________,该物质硬度大,推测该物质为_________晶体。其中Y元素的杂化方式是______。
(6)U的晶体属立方晶系,其晶胞边长为405pm ,密度是2.70g/cm3,通过计算确定其晶胞的类型_____(堆简单立方堆积、体心立方堆积或面心立方最密堆积)(己知:4053=6.64×107)。
【答案】(1)N>O>C;
(2)3d104s1;K、Cr;
(3)C≡O;平面三角形;
(4)CH4>NH3>H2O;3种氢化物的中心原子价层电子多少均为4,VSEPR模型均为正四面体结构,但中心原子的孤电子对数依次增加,导致键角变小;
(5)AlN;原子;sp3;
(6)面心立方最密堆积
【解析】
试题分析:X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子,则Y为N元素;U是第三周期元素形成的简单离子中半径最小的元素,则U为Al;X、Z中未成对电子数均为2,X的原子序数小于N,而Z的原子序数介于N、Al之间,X、Z的核外电子排布分别为1s22s22p2,1s22s22p4,故X为C元素、Z为O元素;W的内层电子全充满,最外层只有1个电子,原子序数大于Al,只能处于第四周期,核外电子数为2+8+18+1=29,故W为Cu元素。
(1)同周期随原子序数增大,第一电离能呈增大趋势,但N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C,故答案为:N>O>C;
(2)W为Cu元素,价电子排布式为3d104s1,W同周期的元素中,与W原子最外层电子数相等的元素还有3p64s1,为K元素、3d54s1,为Cr元素,故答案为:3d104s1;K、Cr;
(3)根据等电子体原理,可知化合物CO与N2互为等电子体,CO的结构式是C≡O,YZ2-为NO2-,中心原子价层电子对数=2+![]() ×(5+1-2×2)=3,VSEPR模型是平面三角形,故答案为:C≡O;平面三角形;
×(5+1-2×2)=3,VSEPR模型是平面三角形,故答案为:C≡O;平面三角形;
(4)X、Y、Z的最简单氢化物分别为CH4、NH3、H2O,3种氢化物的中心原子价层电子对数均为4,VSEPR模型均为正四面体形,但中心原子的孤电子对数依次增大,导致键角变小,故键角:CH4>NH3>H2O,故答案为:CH4>NH3>H2O;3种氢化物的中心原子价层电子对数均为4,VSEPR模型均为正四面体形,但中心原子的孤电子对数依次增大,导致键角变小;
(5)晶胞中N原子数目为4,Al原子数目为8×![]() +6×
+6×![]() =4,故该化合物化学式为AlN,该物质硬度大,属于原子晶体,Y原子形成4个共价键,故Y原子杂化方式为sp3,故答案为:AlN;原子;sp3;
=4,故该化合物化学式为AlN,该物质硬度大,属于原子晶体,Y原子形成4个共价键,故Y原子杂化方式为sp3,故答案为:AlN;原子;sp3;
(6)设晶胞中Al原子数目为N(Al),则N(Al)×![]() g=(405×10-10)3×2.70g/cm3,解得N(Al)=4.00,所以其晶胞的类型面心立方密堆积,故答案为:面心立方最密堆积。
g=(405×10-10)3×2.70g/cm3,解得N(Al)=4.00,所以其晶胞的类型面心立方密堆积,故答案为:面心立方最密堆积。

