题目内容
【题目】A + B → X + Y + H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当 A、B的物质的量之比为1∶4且A为黑色固体时,该反应的离子方程式是
;
②当 A、B的物质的量之比为1∶6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移:_________________________________________。
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1∶2时,则A可能为______________,检查其中刺激性气体产物X的方法是____________________。
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1∶4反应。过量的A和100mL,2mol/L的B溶液充分反应后,将溶液稀释至500mL,溶液中阴离子的物质的量浓度为______ _______。
(4)若A、B、X、Y均为化合物,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色,则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 。
【答案】(1) ① MnO2 + 4H+ + 2Cl— ![]() Mn2+ + Cl2↑ + 2H2O (2分)
Mn2+ + Cl2↑ + 2H2O (2分)
② 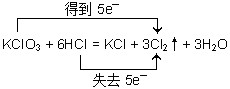 (2分)
(2分)
(2) C或Cu (2分);(填一种即可)
将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2 (或其它合理答案) (2分)
(3) 0.3mol/L (2分);
(4) NaAlO2 NaCl(2分)
【解析】
试题分析:(1)若Y为黄绿色氯气:①当 A、B的物质的量之比为1∶4且A为黑色固体时,是二氧化锰与浓盐酸反应制取氯气,该反应的离子方程式是MnO2 + 4H+ + 2Cl— ![]() Mn2+ + Cl2↑ + 2H2O;②当 A、B的物质的量之比为1∶6时,是高锰酸钾与浓盐酸反应制取氯气,该反应的化学方程式,并用双线桥表示反应过程中的电子转移:②
Mn2+ + Cl2↑ + 2H2O;②当 A、B的物质的量之比为1∶6时,是高锰酸钾与浓盐酸反应制取氯气,该反应的化学方程式,并用双线桥表示反应过程中的电子转移:②  。
。
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1∶2时,则A可能为C或Cu ,产生气体是刺激性气体是二氧化硫,检验的方法是将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2。
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1∶4反应。A是铁,B是硝酸;过量的铁和100mL,2mol/L的硝酸溶液充分反应后,生成硝酸亚铁和一氧化氮,![]() ,02mol硝酸生成0.075mol硝酸亚铁,硝酸根离子的浓度是
,02mol硝酸生成0.075mol硝酸亚铁,硝酸根离子的浓度是![]() 0.3mol/L。
0.3mol/L。
(4)若A、B、X、Y均为化合物,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,含有氯离子;B的焰色为黄色,含有钠元素;则是氯化铝、B是氢氧化钠,1:4反应后,溶液中溶质的化学式为NaAlO2 NaCl。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:[
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是: ,碱性最强的化合物的电子式是: 。
(2)最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 。
(3)用电子式表示元素④与⑥的化合物的形成过程: 。
(4)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_______(要求用离子符号表示)。
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为: 。
