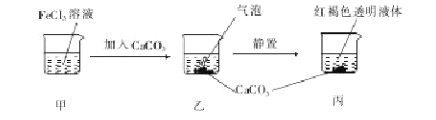
题目内容
【题目】Ⅰ.下图所示为实验室常见气体制备、净化、干燥、收集和性质等实验所用到的部分仪器,某校化学兴趣小组利用这些仪器进行实验探究,请你参与实验并完成有关问题:
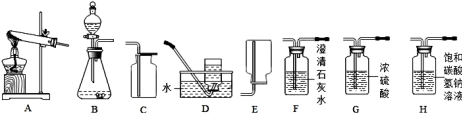
(1)甲组同学用加热高锰酸钾的方法制取氧气,应选择的发生装置为 (填字母序号);若他们选用D装置来收集O2,当气体收集满后,从水槽中取出集气瓶的操作为 。
(2)乙组同学以石灰石和稀盐酸为原料,制备并收集一瓶干燥、纯净的二氧化碳气体,按要求设计实验装置、连接仪器、并检验装置的气密性、所选仪器的连接顺序应为: → → → ;请用离子方程式表示H瓶中饱和NaHCO3溶液的作用: ;若将少量二氧化碳气体通入澄清石灰水中,发生反应的离子方程式为 。
Ⅱ.某校化学实验室有四瓶失去标签的溶液,分别标为A、B、C、D,已知它们是碳酸钠溶液、氯化钡溶液、硫酸钠溶液和稀盐酸中的一种。该校化学兴趣小组的同学进行以下实验探究来鉴别这四种溶液。
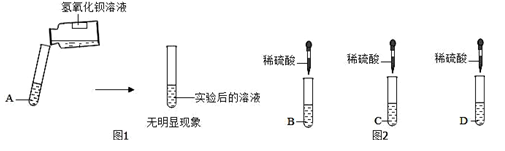
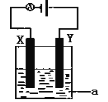
(3)丙同学的实验操作如图1所示,由此你推断该同学认为A一定不是 ;然后他再接着向实验后的混合溶液中滴加酚酞试液,发现混合溶液由无色变为红色,则丙同学得出结论:A一定是氯化钡溶液。
(4)丁同学则不同意丙同学的结论,你认为丁同学的理由是 ;于是丁同学另取少量A于试管中,向其中滴加一种试剂为 (注:只能从下列备选试剂中选择一种!),根据所选试剂他应该观察到的明显现象为 ;
A.饱和食盐水 B.K2CO3溶液 C.蒸馏水 D.紫色石蕊试液
由此证明了丙同学的结论是错误的;同时也确定了A的成分。
(5)戊同学的实验操作如图2所示,实验时观察到C中产生气泡,D中产生白色沉淀。写出D中发生反应的离子方程式 。
【答案】
Ⅰ.(1)A;先在水下盖上玻璃片,再将集气瓶取出正立(同时将导管从水槽中取出来。注:此点不作要求!)
(2)B →H →G →C ;HCO3―+ H+= H2O + CO2↑;CO2 + Ca2+ +2OH ―= CaCO3↓ + H2O
Ⅱ.(3)碳酸钠和硫酸钠溶液
(4)若A是稀盐酸,氢氧化钡与之反应后过量,也能使酚酞溶液变红(或酚酞溶液变红只能说明实验后的溶液中还有氢氧化钡,不能说明A是氯化钡溶液);b(或d);产生气泡(或反应液变为红色)[注:所选试剂与实验现象一定要对应,否则不给分!]
(5)SO42―+Ba2+ = BaSO4↓
【解析】
试题分析:Ⅰ.(1)高锰酸钾制取氧气,需加热,发生装置选择A;若使用是加热固体制取氧气的方法,利用排水法收集气体收集完毕时要先移导管,防止水倒吸引起试管炸裂,若用固体和液体混合反应制取氧气,则利用排水法收集完毕,应在水下用玻璃片盖上集气瓶口,然后将集气瓶移出来,具体操作为先在水下盖上玻璃片,再将集气瓶取出正立;故答案为:(1)A、将导管从水槽中移出来(或在水下盖上玻璃片,将集气瓶移出)
(2)以石灰石和稀盐酸为原料制取并收集干燥、纯净的二氧化碳,应该先选择固液反应的A装置作为发生装置,再通碳酸氢钠溶液除去氯化氢杂质,再通过浓硫酸吸水干燥,二氧化碳密度比空气大,然后用向上排空气法收集,故连接的顺序为:B→H→G→C;碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳,反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;若将少量二氧化碳通入澄清的石灰水中,二氧化碳和石灰水反应生成碳酸钙沉淀和水,反应的离子方程式为:CO2 + Ca2+ +2OH ―= CaCO3↓ + H2O;故答案为:B → H → G → C ;NaHCO3 + HCl = NaCl + H2O + CO2↑ ;CO2 + Ca2+ +2OH ―= CaCO3↓ + H2O;
Ⅱ.(1)由于氢氧化钡与碳酸钠反应生成碳酸钡沉淀,与硫酸钠反应生成硫酸钡沉淀,所以加入氢氧化钡没有现象,说明一定不是碳酸钠、硫酸钠,故答案为:碳酸钠溶液或硫酸钠溶液;
(2)若A是稀盐酸,氢氧化钡与稀盐酸反应后氢氧化钡过量,溶液显碱性也能使酚酞溶液变红;由于氯化钡与碳酸钠反应生成碳酸钡白色沉淀,所以如果加入碳酸钠,没有现象,说明不能是氯化钡;盐酸与碳酸钠反应生成氯化钠、水、二氧化碳,所以现象是有气泡产生,故答案为:若A是稀盐酸,氢氧化钡与稀盐酸反应后氢氧化钡过量,也能使酚酞溶液变红(或酚酞溶液变红只能说明实验后的溶液中有氢氧化钡,不能说明A是氯化钡溶液);碳酸钠溶液(或碳酸钾溶液;或紫色石蕊溶液);产生气泡(或产生气泡;或紫色石蕊溶液变为红色);
(3)D中产生白色沉淀.说明含有钡离子,即氯化钡,所以反应物是硫酸和氯化钡,生成物是硫酸钡和盐酸,反应的离子方程式为:SO42―+Ba2+ = BaSO4↓,故答案为:SO42―+Ba2+ = BaSO4↓。

【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:[
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是: ,碱性最强的化合物的电子式是: 。
(2)最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 。
(3)用电子式表示元素④与⑥的化合物的形成过程: 。
(4)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_______(要求用离子符号表示)。
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为: 。