题目内容
【题目】I.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强 ②混合气体的密度③混合气体的总物质的量 ④混合气体的平均相对分子质量 ⑤混合气体的颜色。
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是______(填序号,下同)。
2SO3(g)达到平衡状态的是______(填序号,下同)。
(2)一定能证明 A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是_______。(注:B、C、D均为无色物质)
C(g)+D(g)达到平衡状态的是_______。(注:B、C、D均为无色物质)
II.某温度时,在一个1L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
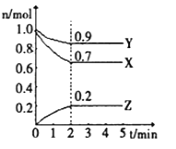
(1)反应开始至2min,以气体Y表示的平均反应速率为________;
(2)该反应的化学方程式为___________;
(3)X的转化率___________,生成的Z的百分含量___________
(4)amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
【答案】①③④ ②④ 0.05mol(/L·min) 3X+Y![]() 2Z 30%
2Z 30% ![]() 7:5
7:5
【解析】
Ⅰ(1)反应2SO2(g)+O2(g)![]() 2SO3(g)中各物质均没有颜色,且正反应是气体分子数减小的反应;
2SO3(g)中各物质均没有颜色,且正反应是气体分子数减小的反应;
①恒温恒容条件下,气体的压强之比等于气体的物质的量之比,反应前后,气体的物质的量在改变,因此压强也会改变,当压强不变时,说明气体的物质的量不变,反应达到平衡,①符合题意;
②根据![]() ,容器体积不变,各物质均为气体,气体质量不变,因此密度一直不变;则密度不变,不能判断反应是否达到平衡,②不符合题意;
,容器体积不变,各物质均为气体,气体质量不变,因此密度一直不变;则密度不变,不能判断反应是否达到平衡,②不符合题意;
③该反应,气体的总物质的量发生改变,当气体的总物质的量不变时,说明各物质的物质的量不变,反应达到平衡,③符合题意;
④根据![]() ,气体的总质量不变,但是气体的总物质的量变化,说明平均相对分子质量变化,当其不变的时候,说明各物质的物质的量不变,反应达到平衡,④符合题意;
,气体的总质量不变,但是气体的总物质的量变化,说明平均相对分子质量变化,当其不变的时候,说明各物质的物质的量不变,反应达到平衡,④符合题意;
⑤反应中各物质均没有颜色,因此颜色不变,不能判断反应是否达到平衡,⑤不符合题意;
综上一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的有①③④;
2SO3(g)达到平衡状态的有①③④;
(2)反应A(s)+2B(g)![]() C(g)+D(g)中各物质均没有颜色,且反应前后气体分子数不变;
C(g)+D(g)中各物质均没有颜色,且反应前后气体分子数不变;
①恒温恒容条件下,气体的压强之比等于气体的物质的量之比,反应前后,气体的物质的量不变,因此压强总不变,当压强不变时,不能判断反应是否达到平衡,①不符合题意;
②根据![]() ,容器体积不变,A为固体,气体的质量会发生改变,因此密度会变化,当密度不变时,说明各物质的质量不变,反应达到平衡,②符合题意;
,容器体积不变,A为固体,气体的质量会发生改变,因此密度会变化,当密度不变时,说明各物质的质量不变,反应达到平衡,②符合题意;
③该反应,气体的总物质的量一直不变;当气体的总物质的量不变时,不能判断反应是否达到平衡,③不符合题意;
④根据![]() ,气体的物质的量不变,但A为固体,气体的质量会发生改变,说明平均相对分子质量变化,当其不变的时候,说明各物质的质量不变,反应达到平衡,④符合题意;
,气体的物质的量不变,但A为固体,气体的质量会发生改变,说明平均相对分子质量变化,当其不变的时候,说明各物质的质量不变,反应达到平衡,④符合题意;
⑤反应中各物质均没有颜色,因此颜色不变,不能判断反应是否达到平衡,⑤不符合题意;
综上一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是②④;
C(g)+D(g)达到平衡状态的是②④;
Ⅱ(1)反应开始至2min,Y的物质的量变化了1.0mol-0.9mol=0.1mol,则其平均速率![]() ;
;
(2)根据图像,X、Y的物质的量在减小,X、Y是反应物,X减小了0.3mol,Y减小了0.1mol,Z的物质的量在增加,Z为生成物,增加了0.2mol;在一化学反应中,各物质的物质的量变化量之比等于化学计量数之比,则该反应的化学方程式为3X+Y![]() 2Z;
2Z;
(3)根据图像,X开始物质的量为1mol,平衡时其物质的量为0.7mol,反应了0.3mol,则其转化率![]() ;生成的Z的百分含量
;生成的Z的百分含量![]() ;
;
(4)设反应转化了xmolY,根据化学方程式3X+Y![]() 2Z,消耗了3xmolX,生成了2xmolZ,则剩余的(a-3x)molX和(b-x)molY,得到了2xmolZ,根据已知,则(a-3x)=(b-x)=2×2x,解得a=7x,b=5x,则a:b=7x:5x=7:5。
2Z,消耗了3xmolX,生成了2xmolZ,则剩余的(a-3x)molX和(b-x)molY,得到了2xmolZ,根据已知,则(a-3x)=(b-x)=2×2x,解得a=7x,b=5x,则a:b=7x:5x=7:5。
![]()

【题目】在相同的密闭容器中,用两种不同方法制得的![]() 分别进行催化分解水的实验:
分别进行催化分解水的实验:![]()
![]() ,水蒸气的浓度
,水蒸气的浓度![]() 随时间
随时间![]() 变化如下。
变化如下。
序号 |
| 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法I |
|
|
|
|
|
|
|
| p>② | 方法II |
|
|
|
|
|
|
|
③ | 方法II |
|
|
|
|
|
|
|
下列叙述正确的是
A.实验①、②、③的化学平衡常数的关系:![]()
B.实验①比实验②所用的![]() 催化效率高
催化效率高
C.实验的温度:![]()
D.实验①前20min的平均反应速率![]()
