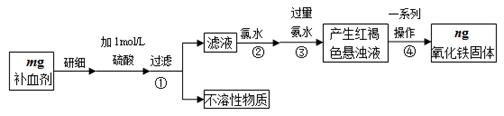
题目内容
为了检验市场上常见两种金属饮料瓶的主要成分,某小组取甲、乙两种饮料瓶,将其剪碎作为样品,分别按下述步骤进行实验:
I.取少量样品于试管中,加入盐酸,充分反应后过滤。
II.取少量滤液于试管中,向其中滴加氢氧化钠溶液。
步骤II的实验现象如下:
| 样品甲 | 生成白色沉淀,继续滴加氢氧化钠溶液,沉淀消失 |
| 样品乙 | 生成白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色 |
(1)样品甲中金属的主要成分是 ,生成白色沉淀反应的离子方程式是 。
(2)样品乙进行步骤I后所得滤液中一定含有的金属离子是 ,白色沉淀变为红褐色反应的化学方程式是 。
(1)Al Al3++3OH—="=" Al(OH)3↓ (2)Fe2+ 4Fe(OH)2 + O2+2H2O == 4Fe(OH)3
解析试题分析:样品甲:2Al+6HCl=2AlCl3+3H2↑. AlCl3+3NaOH= Al(OH)3↓+3NaCl. Al(OH)3+OH-=AlO2-+ H2O;
样品乙: Fe+2HCl=FeCl2+H2↑. FeCl2+2NaOH= Fe(OH)2↓+3NaCl, 4Fe(OH)2 + O2+2H2O == 4Fe(OH)3
故样品甲中金属的主要成分是是铝,生成白色沉淀反应的离子方程式是Al3++3OH—="=" Al(OH)3↓(2)样品乙进行步骤I后所得滤液中一定含有的金属离子是Fe2+白色沉淀变为红褐色反应的化学方程式是: 4Fe(OH)2 + O2+2H2O == 4Fe(OH)3。
考点:考查金属Fe、Al的性质及化合物的相互转化的知识。

一位学生对铁与氧化铁反应后的产物进行探究。
(1)提出假设
假设1:产物为FeO;
假设2:__________________。
(2)查阅资料
该学生通过查阅资料得知:在铁的三种氧化物中,四氧化三铁最稳定,氧化亚铁最不稳定,常温下极易被氧气氧化成氧化铁(颜色由黑色变成红色)。
通过查阅资料可以得出的初步结论为_________________________________。
(3)进行实验
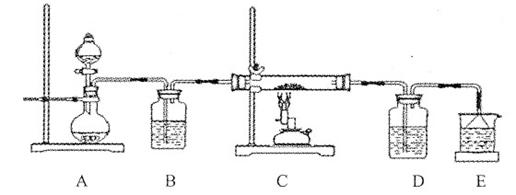
该学生设计了如下装置进行铁与氧化铁反应的实验。请你帮助他将实验步骤补充完整。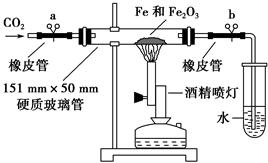
按如图装置连接好仪器(暂不装入药品),___________________ ____。
②称取1 g还原性铁粉和5 g氧化铁粉末,混合均匀后平摊在玻璃管中部。
③松开两个弹簧夹,_______________________________________________,
即可夹上弹簧夹a,并开始加热药品。
④大约4分钟左右,棕色粉末全部变黑;再夹上弹簧夹b,然后停止加热,等到玻璃管冷却至室温,倒出黑色粉末。
(4)现提供如下药品,验证实验得到的黑色粉末的成分。磁铁、稀盐酸、KSCN溶液、酸性KMnO4溶液、试管、胶头滴管。
| 实验步骤 | 预期现象和结论 |
| | |
(5)实验结论:铁与氧化铁反应的化学方程式为___________________________
为测定Na2CO3和NaHCO3固体混合物中Na2CO3的质量分数,称取一定质量的样品,甲同学利用图I所示装置测量产生CO2的体积,乙同学利用图II所示装置通过干燥管的增重测量产生CO2的质量,已知所用稀硫酸均足量。
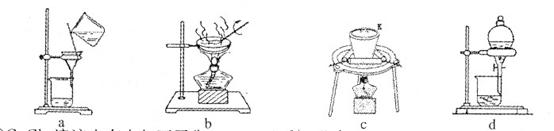
(l)盛放稀硫酸的仪器名称为 ;
(2)试剂X为 ,试剂Y为 ;
(3)甲同学在进行实验时,为减小误差,应注意的事项有(填选项字母) ;
| A.读数前应使整套装置冷却至室温 |
| B.调整Z的高度使量气装置左右液面相平 |
| C.读数时视线与Z内凹液面最低点相切 |
| D.读数前应通入一定量的N2使生成的CO2全部进入量气装置 |
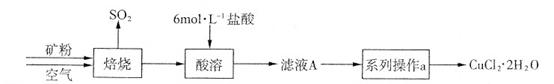
铁铜单质及其化合物的应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯: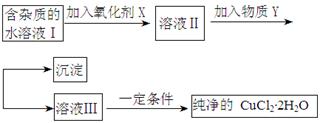
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂的目的是
(2)下列最适合作氧化剂X的是
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是
(4)如果不用物质Y而直接用可溶性碱溶液能不能达到目的? (填“能”或者“不能”)。若不能,试解释原因 (若填“能”,此空不用回答)
(5)最后能不能直接蒸发得到CuCl2·2H2O? (填“能”或者“不能”)。若不能,应该如何操作才能得到CuCl2·2H2O (若填“能”,此空不用回答)
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是
(7)若向溶液Ⅱ中加入镁粉,产生的气体是 ,试解释原因
(8)FeCl3溶液具有净水作用的原因是
 CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。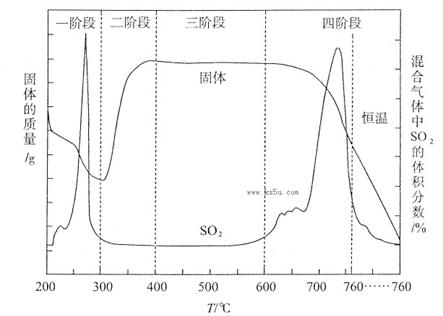


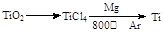
 MgO+H2↑ Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
MgO+H2↑ Mg3N2 +6H2O =3Mg(OH)2+2NH3↑