题目内容
某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下: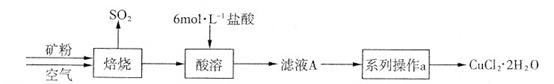
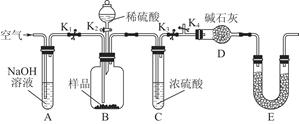
(1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6 mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有 、 。
(2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是 (填下列各项中序号)。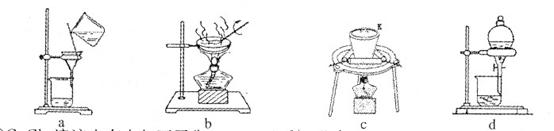
②CuCl2溶液中存在如下平衡:Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是 (填下列各项中序号)。
a.FeCl3固体 b.CuCl2固体 c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO2生成曲线如下图所示。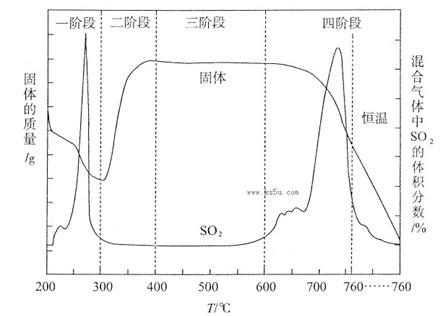
①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为:
第①步转化主要在200~300oC范围内进行,该步转化的化学方程式为 。
②300~400oC范围内,固体质量明显增加的原因是 ,上图所示过程中,CuSO4固体能稳定存在的阶段是 (填下列各项中序号)。
a.一阶段 b、二阶段 c、三阶段 d、四阶段
③该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。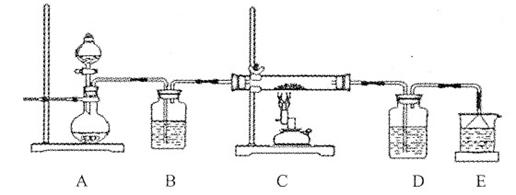
a.装置组装完成后,应立即进行的一项操作是 。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物。你认为装置D中原来盛有的溶液为 溶液。
c.若原CuS矿样的质量为l0.0 g,在实验过程中,保持温度在760oC左右持续加热,待矿样充分反应后,石英玻璃管内所得固体的质量为8.0 g,则原矿样中CuS的质量分数为 。
(1)(4分)胶头滴管(2分) 500mL容量瓶(2分)
(2)(4分)①cd(2分)②c(2分)
(3)(12分)①2CuS+O2=Cu2S+SO2(2分)②Cu2S转化为CuSO4(2分) c(2分)
③a.检验装置的气密性(2分) b.氯化钡(BaCl2)(2分) c.96%(2分)
解析试题分析:(1)由浓盐酸配制稀盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还需要:胶头滴管、500mL容量瓶。
(2)①由CuCl2溶液制取CuCl2?2H2O,需要进行蒸发浓缩、降温结晶,然后过滤可得CuCl2?2H2O晶体,所以不需要c、d操作。
②FeCl3溶液为黄色,CuCl2溶液为蓝色,对原平衡体系溶液的颜色产生干扰,而加入蒸馏水可使平衡向逆反应方向移动,溶液的颜色发生改变,可证明滤液A(绿色)中存在上述平衡,故c项正确。
(3)①根据流程图CuS与O2反应生成Cu2S,还应生成SO2,化学方程式为:2CuS+O2=Cu2S+SO2
②第②步转化,由Cu2S转化为CuO?CuSO4,所以300~400oC范围内,固体质量明显增加的原因是Cu2S转化为CuSO4;第二阶段生成了CuSO4,第四阶段固体质量减小,CuSO4发生了分解反应,所以CuSO4固体能稳定存在的阶段是第三阶段。
③a.实验装置组装完后应首先检验装置的气密性;b. SO2与BaCl2不反应,SO2、O2与BaCl2溶液反应可以生成BaSO4沉淀,所以装置D中原来盛有的溶液为BaCl2溶液;c. 矿样充分反应后,石英玻璃管内所得固体CuO,根据Cu元素质量守恒,可知CuS ~ CuO ,所以CuS的质量为8g÷80g/mol×96g/mol=9.6g,则原矿样中CuS的质量分数为:9.6g÷10.0g×100%=96%
考点:本题考查基本仪器、基本操作、化学平衡、化学方程式的书写、化学计算。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案(14分)铁、铝、铜、硅及其合金材料在生产生活中有着广泛的应用。请回答下列有关问题。
(1)目前已冶炼出纯度达99.9999%的铁。下列关于纯铁的叙述错误的是
(填字母)。
| A.硬度比钢小,熔点比钢高 | B.不能与盐酸反应 |
| C.与不锈钢成分相同 | D.在冷的浓硫酸中钝化 |
(2)铝热反应可用于焊接钢轨、冶炼熔点较高的金属。请写出用V2O5冶炼钒的化学方程式:
(3)①铜在干燥的空气中性质稳定,在潮湿的空气里会被锈蚀形成一层绿色的铜锈,反应的化学方程式是
②工业上常以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S
 6Cu+SO2↑,该反应的氧化剂是
6Cu+SO2↑,该反应的氧化剂是 ③将铜粉放入稀硫酸中加热并不断鼓入空气,铜溶解,产物只有硫酸铜与水 。
该反应的化学方程式: ,
此法比直接用浓硫酸与铜反应有两个明显的优点:
。
(4)制备高纯硅的流程如下图:

写出石英砂制备粗硅的化学方程式:
。
某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
【实验操作】将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计方案】该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀 ②无明显现象 | 白色物质为Na2CO3 |
回答下列问题:
(1)写出金属镁与二氧化碳反应的化学方程式: 。
(2)甲同学认为方案1得到的结论不正确,其理由是 。
(3)乙同学认为方案2得到的结论正确,白色物质为 。
(4)钠在二氧化碳中燃烧的化学反应方程式为 。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由: 。
我国化工专家侯德榜,勇于创新,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。请完成下列问题:
(1)“联合制碱法”制得的“碱”是 (填化学式)。
(2)氨碱法和联合制碱法是两大重要的工业制碱法,下列表达中,不正确的是 。
| | | 氨碱法 | 联合制碱法 |
| A | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B | 可能的副产物 | 氯化钙 | 氯化铵 |
| C | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |
某实验小组,利用下列装置模拟“联合制碱法”。

(3)取上述仪器连接装置,顺序为:(a)接( )、( )接( );(b)接( );
检验气密性后装入药品,应该先让 装置(填上述字母)先发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体。
(4)C中用球形干燥管而不用直导管,其作用是 ,D中应选用的液体为 ;
(5)C中广口瓶内产生固体的总化学方程式为 。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为: (注明你的表达式中所用的有关符号的含义)。
在呼吸面具和潜水艇中可用Na2O2作为供氧剂,请选择适当的化学试剂和实验用品,用下图中的实验装置进行试验,证明Na2O2可作供氧剂。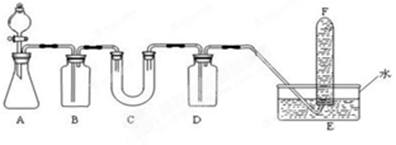
(1)A是制取CO2的装置。在实验室里,CO2常用稀盐酸与石灰石反应来制取,反应的化学方程式为: 。(2分)
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | (2分) |
| C | Na2O2 | (2分) |
| D | NaOH溶液 | (2分) |
(3)Na2O2与CO2反应的化学方程式: 。(2分)
(4)试管F中收集满气体后,下一步验操作是: 。(2分)
绿矾是一种重要的化工原料。
【问题1】绿矾晶体(FeSO4·7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质。为探究绿矾样品的变质情况,某化学兴趣小组的同学设计了下列实验方案。
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液。
(1)方案1:取少量溶液,加入几滴 试剂(写化学式),如果观察到的现象是溶液变血红色;实验结论:证明绿矾样品已被氧化。
(2)方案2:取少量溶液,加入几滴酸性KMnO4溶液,如果观察到的现象是 。实验结论:证明绿矾样品完全被氧化。
(3)使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式 。
(4)要从FeSO4溶液中得到绿矾晶体,必须进行的实验操作步骤: 、冷却结晶、 过滤、自然干燥,在这一系列操作中没有用到的仪器有 (此空填序号)
| A.蒸发皿 | B.石棉网 | C.烧杯 | D.玻璃棒 |
工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的气体产物中是否含有SO2和SO3,进行如下实验:将FeSO4高温分解产生的气体通入下图所示的装置中。请回答以下问题:

(1)装置I中氯化钡溶液中可观察到现象 。若氯化钡溶液足量,将最后所得沉淀过滤、洗涤、烘干后称重为2.33克,则灼烧绿矾的过程中转移了_________mol的电子。
(2)装置II中试剂为品红溶液,其作用是
(3)装置III中试剂为NaOH溶液,其作用是 。
为了检验市场上常见两种金属饮料瓶的主要成分,某小组取甲、乙两种饮料瓶,将其剪碎作为样品,分别按下述步骤进行实验:
I.取少量样品于试管中,加入盐酸,充分反应后过滤。
II.取少量滤液于试管中,向其中滴加氢氧化钠溶液。
步骤II的实验现象如下:
| 样品甲 | 生成白色沉淀,继续滴加氢氧化钠溶液,沉淀消失 |
| 样品乙 | 生成白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色 |
(1)样品甲中金属的主要成分是 ,生成白色沉淀反应的离子方程式是 。
(2)样品乙进行步骤I后所得滤液中一定含有的金属离子是 ,白色沉淀变为红褐色反应的化学方程式是 。
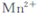 )可以测定H2O2的含量?
)可以测定H2O2的含量?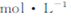 KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10mL KMnO4溶液?
KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10mL KMnO4溶液? ?
?