题目内容
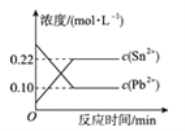
【题目】某温度时,在2L容器中A,B两种物质间的转化反应中,A,B物质的量随时间变化的曲线如图所示,由图中数据分析得: 
(1)该反应的化学方程式为
(2)反应开始至4min时,A的平均反应速率为 .
(3)4min时,反应是否达到平衡状态?(填“是”或“否”), 8min时,v(正)v(逆)(填“>”、“<”或“=”).
【答案】
(1)2A?B
(2)0.05mol/L?min
(3)否;=
【解析】解:(1)图象分析A为反应物,B为生成物,物质的量不变化说明反应达到平衡状态,依据AB消耗的物质的量之比计算得到化学方程式的计量数之比,A物质的量变化=0.8mol﹣0.2mol=0.6mol;B变化物质的量=0.5mol﹣0.2mol=0.3mol,AB反应的物质的量之比2:1,所以反应的化学方程式:2AB,所以答案是:2AB;(2)反应开始至4min时,A物质的量变化=0.8mol﹣0.4mol=0.4mol,A的平均反应速率= ![]() =0.05mol/Lmin,所以答案是:0.05mol/Lmin;(3)图象分析随时间变化AB物质的量发生变化,说明未达到平衡,8分钟时AB物质的量不变,说明反应达到平衡状态,所以答案是:否;=.
=0.05mol/Lmin,所以答案是:0.05mol/Lmin;(3)图象分析随时间变化AB物质的量发生变化,说明未达到平衡,8分钟时AB物质的量不变,说明反应达到平衡状态,所以答案是:否;=.
【考点精析】利用反应热和焓变对题目进行判断即可得到答案,需要熟知在化学反应中放出或吸收的热量,通常叫反应热.

【题目】A,B,C为短周期元素,在周期表中所处的位置如表所示.
A | C | |
B |
A、C两元素的原子核外电子数之和等于B原子的质子数.
(1)写出B,C元素的名称、 .
(2)B位于元素周期表中第周期第族.
(3)用石墨为电极,电解B元素的最高价氧化物的水化物的水溶液,当电路中转移0.4mol电子时,在阴极收集到的产物是 , 质量为g,电解的总反应方程式为;
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式 .