题目内容
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8 molL﹣1 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为_____。
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填字母序号,下同).
A.c(H+) B.![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D.![]() E.
E. 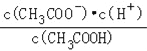
若升高该溶液温度(不考虑醋酸挥发),上述5种表达式的数据增大的是_____.
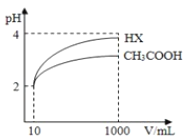
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中水电离出来的c(H+)_____(填“大于”、“等于”或“小于”)醋酸的溶液中水电离出来的c(H+),理由是_____.
(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,该溶液显_____(填“酸”、“碱”或“中”)性.将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,则a:b=_____。
【答案】 CO32﹣>ClO﹣>HCO3﹣>CH3COO﹣ A ABCE 大于 大于 HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱 碱 11:9
【解析】(1)酸根离子对应酸的酸的电离平衡常数越大,则其结合氢离子能力越弱,由于电离平衡常数CH3COOH>H2CO3>HCO3﹣>HClO,则同浓度CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为:CO32﹣>ClO﹣>HCO3﹣>CH3COO﹣;(2)A.0.1mol·L﹣1的CH3COOH溶液加稀释过程中,溶液中氢离子浓度减小,选项A正确;B.0.1mol·L﹣1的CH3COOH溶液加稀释过程中,各个微粒浓度减小,同时醋酸的电离向右移动,c(H+)减小的程度小于c(CH3COOH)的减小程度,则![]() 增大,选项B错误;C.Kw=c(H+)·c(OH﹣)只受温度的影响,温度不变则其值是一个常数,选项C错误;D.醋酸稀释,酸性减弱,c(H+)减小,水的离子积不变,则c(OH﹣)增大,所以
增大,选项B错误;C.Kw=c(H+)·c(OH﹣)只受温度的影响,温度不变则其值是一个常数,选项C错误;D.醋酸稀释,酸性减弱,c(H+)减小,水的离子积不变,则c(OH﹣)增大,所以![]() 增大,选项D错误;E.
增大,选项D错误;E.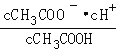 为醋酸的电离平衡常数,由于温度不变,则水的电离平衡常数不变,选项E错误;答案选A;若该溶液升高温度,醋酸、水的电离程度对增大,则溶液中氢离子、氢氧根离子浓度都增大,A.升高温度后溶液中氢离子浓度c(H+)增大,选项A正确;B.升高温度后氢离子、氢氧根离子浓度都增大,醋酸的浓度减小,则
为醋酸的电离平衡常数,由于温度不变,则水的电离平衡常数不变,选项E错误;答案选A;若该溶液升高温度,醋酸、水的电离程度对增大,则溶液中氢离子、氢氧根离子浓度都增大,A.升高温度后溶液中氢离子浓度c(H+)增大,选项A正确;B.升高温度后氢离子、氢氧根离子浓度都增大,醋酸的浓度减小,则![]() 的比值增大,选项B正确;C.c(H+)·c(OH﹣)为水的离子积,升高温度后水的电离程度增大,则水的离子积增大,选项C正确;D.升高温度后氢氧根离子、氢离子浓度都增大,但氢氧根离子浓度增大的幅度大于氢氧根离子,所以
的比值增大,选项B正确;C.c(H+)·c(OH﹣)为水的离子积,升高温度后水的电离程度增大,则水的离子积增大,选项C正确;D.升高温度后氢氧根离子、氢离子浓度都增大,但氢氧根离子浓度增大的幅度大于氢氧根离子,所以![]() 的比值减小,选项D错误;E.
的比值减小,选项D错误;E.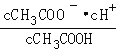 为醋酸的电离平衡常数,升高温度后产生的电离平衡常数增大,选项E正确;答案选ABCE;(3)根据图象分析知道,起始是两种溶液中c(H+)相同,c(较弱酸)>c(较强酸),稀释过程中较弱酸的电离程度增大,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HX的pH变化比CH3COOH的大,故HX酸性强,电离平衡常数大;HX酸性强于CH3COOH的,稀释后HX溶液中c(H+)小于CH3COOH溶液中的c(H+),所以其对水的抑制能力减弱;(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,c(H+)=10-7mol/L,c(OH-)=
为醋酸的电离平衡常数,升高温度后产生的电离平衡常数增大,选项E正确;答案选ABCE;(3)根据图象分析知道,起始是两种溶液中c(H+)相同,c(较弱酸)>c(较强酸),稀释过程中较弱酸的电离程度增大,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HX的pH变化比CH3COOH的大,故HX酸性强,电离平衡常数大;HX酸性强于CH3COOH的,稀释后HX溶液中c(H+)小于CH3COOH溶液中的c(H+),所以其对水的抑制能力减弱;(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,c(H+)=10-7mol/L,c(OH-)=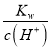 =
=![]() =10-5mol/L,c(H+)< c(OH-),溶液显碱性;PH=1的H2SO4溶液c(H+)=0.1mol/L,PH=11的NaOH溶液c(OH-)=
=10-5mol/L,c(H+)< c(OH-),溶液显碱性;PH=1的H2SO4溶液c(H+)=0.1mol/L,PH=11的NaOH溶液c(OH-)=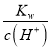 =
=![]() =0.1mol/L,将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,证明酸过量,则
=0.1mol/L,将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,证明酸过量,则![]() =10-2mol/L,解得a:b=11:9。
=10-2mol/L,解得a:b=11:9。

 阅读快车系列答案
阅读快车系列答案