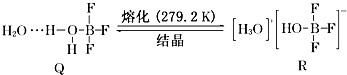
题目内容
13.常温下,在浓度为10-4mol/L的盐酸溶液中,c(OH-)=10-10mol/L,将上述盐酸稀释10倍,溶液中c(H+)=10-5mol/L,c(OH-)=10-9mol/L,将上述溶液稀释10000倍,溶液中c(H+)≈10-7mol/L,c(OH-)≈10-7mol/L.分析 根据c(OH-)=$\frac{{K}_{w}}{c(O{H}^{-})}$计算出溶液中氢离子浓度;溶液稀释10倍,溶液中氢离子浓度变为原先的$\frac{1}{10}$,而氢氧根离子浓度变为原先的10倍;溶液稀释10000倍后,酸溶液不可能变为碱溶液,溶液中c(H+)≈10-7mol/L、c(OH-)≈10-7mol/L.
解答 解:常温下,在浓度为10-4mol/L的盐酸溶液中,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L;
将该盐酸稀释10倍后,溶液中氢离子浓度为:c(H+)=10-4mol/L×$\frac{1}{10}$=10-5mol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9mol/L;
将上述溶液稀释10000倍,计算出的氢离子浓度为:c(H+)=10-4mol/L×$\frac{1}{10000}$=10-8mol/L,由于溶液中存在大量电离平衡,则此时溶液中
c(H+)≈10-7mol/L、c(OH-)≈10-7mol/L,
故答案为:10-10;10-5;10-9;10-7;10-7.
点评 本题考查了溶液pH的计算、物质的量浓度的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确酸溶液稀释后不可能变为碱溶液,溶液中氢离子浓度只能无限接近10-7mol/L.

练习册系列答案
相关题目
3.在pH=1的溶液中能大量共存的离子组是( )
| A. | Na+、Ca2+、N03-、C032- | B. | Ba2+、K+、HC03-、Al02- | ||
| C. | Na+、NH4+、Cl0-、0H- | D. | Mg2+Al3+、Cl-、S042- |
4.下列说法正确的是( )
| A. | BaO2、NaCl、LiH 三种物质阳离子与阴离子个数比均为:1:1 | |
| B. | CCl4、NH3、PCl3中所有原子都满足最外层为8电子结构 | |
| C. | 甲烷可与溴水发生取代反应,乙烯可与溴水发生加成反应 | |
| D. | 燃料电池是通过燃烧所释放的热能再转化为电能的装置 |
8.下列说法不正确的是( )
| A. | 棉花、蚕丝和锦纶的主要成分是纤维素 | |
| B. | 油脂在空气中完全燃烧生成二氧化碳和水 | |
| C. | 苯、乙醇和乙酸都能发生取代反应 | |
| D. | 淀粉和纤维素的组成通式为(C6H10O5)n,二者互为同分异构体 |
18.下列关于SO2、NO2的说法不正确的是( )
| A. | 两者都能形成酸雨 | B. | 两者都能与NaOH溶液反应 | ||
| C. | 两者都既有氧化性,又有还原性 | D. | 两者与水反应都生产强酸 |
2.锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源.工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂.其中一种工艺流程如下:

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②Li2CO3在不同温度下的溶解度如下表:
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:Li2O•Al2O3•4SiO2.
(2)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(3)写出反应Ⅲ中生成沉淀A的离子方程式:Mg2++2OH-═Mg(OH)2↓、Ca2++CO32-═CaCO3↓.
(4)洗涤所得Li2CO3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(5)将氯化锂溶液蒸干的过程中还需不断通入HCl气体,其作用是抑制LiCl的水解,防止生成LiOH,同时HCl可带走水蒸气
(6)本实验在电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)用氧化物形式表示LiAlSi2O6的组成:Li2O•Al2O3•4SiO2.
(2)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(3)写出反应Ⅲ中生成沉淀A的离子方程式:Mg2++2OH-═Mg(OH)2↓、Ca2++CO32-═CaCO3↓.
(4)洗涤所得Li2CO3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(5)将氯化锂溶液蒸干的过程中还需不断通入HCl气体,其作用是抑制LiCl的水解,防止生成LiOH,同时HCl可带走水蒸气
(6)本实验在电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.
3.在2L密闭容器内,800%C时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)达平衡的时间是3s,理由是3s后NO物质的量不再发生变化.
(2)图中表示NO2的变化的曲线是b,用O2表示从0=2s内该反应的平均速率v(O2)=0.0015mol/(L•s).
(3)能说明该反应一定达到平衡状态的是bd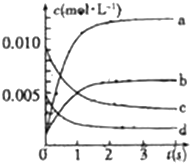
a.v(NO2)=2v(O2)
b.容器内颜色保持不变
c.2V逆 (NO)=v正(O2)
d.容器内压强保持不变
(4)能增大该反应的反应速率是bcd
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b,用O2表示从0=2s内该反应的平均速率v(O2)=0.0015mol/(L•s).
(3)能说明该反应一定达到平衡状态的是bd

a.v(NO2)=2v(O2)
b.容器内颜色保持不变
c.2V逆 (NO)=v正(O2)
d.容器内压强保持不变
(4)能增大该反应的反应速率是bcd
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.