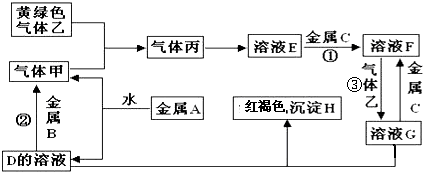
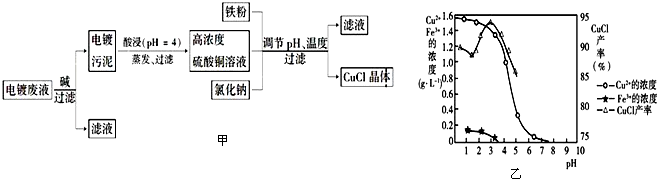
题目内容
4.下列说法正确的是( )| A. | BaO2、NaCl、LiH 三种物质阳离子与阴离子个数比均为:1:1 | |
| B. | CCl4、NH3、PCl3中所有原子都满足最外层为8电子结构 | |
| C. | 甲烷可与溴水发生取代反应,乙烯可与溴水发生加成反应 | |
| D. | 燃料电池是通过燃烧所释放的热能再转化为电能的装置 |
分析 A、过氧化钡中阴离子为过氧根离子;
B、NH3中的氢是2个电子的稳定结构;
C、甲烷可与液溴在光照的条件下发生取代反应;
D、燃料电池是将化学能转化为电能的装置.
解答 解:A、过氧化钡中阴离子为过氧根离子,所以BaO2中钡离子与过氧根离子,NaCl中是钠离子与氯离子,LiH是锂离子与氢负离子,阳离子与阴离子个数比均为:1:1,故A正确;
B、NH3中的氢是2个电子的稳定结构,故B错误;
C、甲烷可与液溴在光照的条件下发生取代反应,而不是溴水,故C错误;
D、燃料电池是将化学能转化为电能的装置,故错误;
故选A.
点评 本题考查不同晶体的结构微粒及微粒间的作用力,和微粒的稳定结构,综合性强,但比较容易.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
12.“北大富硒康”中含有微量元素硒(Se),对人体有保健作用.已知硒为第四周期第ⅥA族元素,根据它在周期表中的位置推测,硒不可能具有的性质为( )
| A. | 硒化氢很稳定 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 非金属性比硫弱 | |
| D. | 其最高价氧化物的水化物酸性强于砷弱于溴 |
19.氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2+O2═2H2O,其中一个电极反应为:O2+2H2O+4e-═4OH-.下列叙述正确的是( )
| A. | H2通入负极区 | B. | O2通入负极区 | ||
| C. | 负极反应为2H2-4e-═4H+ | D. | 溶液中OH-由正极向负极移动 |
9.关于如图所示的原电池,下列说法正确的是( )
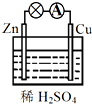

| A. | Cu为正极,SO42+向正极移动 | B. | 电子由铜片通过导线流向锌片 | ||
| C. | 该装置能将电能转化为化学能 | D. | 正极反应为 2H++2e-═H2↑ |
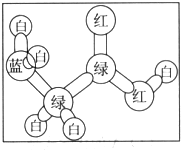 有机物A是构成营养素的基础物质,A的球棍模型如图所示,图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.回答下列问题:
有机物A是构成营养素的基础物质,A的球棍模型如图所示,图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.回答下列问题: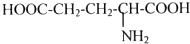 (写结构简式)可以合成二肽
(写结构简式)可以合成二肽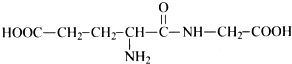
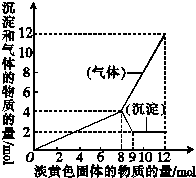 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成.加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,据图可推知溶液中含有的离子是Mg2+、Al3+、NH4+,它们的物质的量浓度之比为c(Mg2+):c(Al3+):c(NH4+)=1:1:3,所加淡黄色固体是Na2O2(填化学式).
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成.加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,据图可推知溶液中含有的离子是Mg2+、Al3+、NH4+,它们的物质的量浓度之比为c(Mg2+):c(Al3+):c(NH4+)=1:1:3,所加淡黄色固体是Na2O2(填化学式).