题目内容
(7分)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年《化学教育》报道了如下实验研究:
实验一、定性研究:
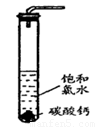
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。 经检测,上述实验中产生的无色气体均为CO2。请回答:
(1)反应后所得的溶液漂白性增强的原因是 。
(2)依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有的溶质的化学式为 。
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
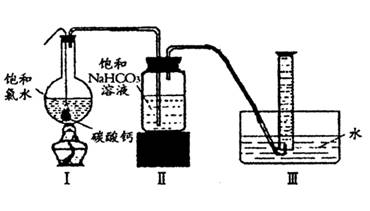
请回答:
(3)实验结束后检测量筒收集到的气体除CO2外还混有O2,请写出I中产生O2的化学反应方程式 。
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造 成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
(7分)(1)CaCO3 消耗了氯水中的 HCl, 使 Cl2+H2O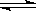 HCl+HClO 平衡向右移动 , HClO 浓度增大
(2分)
HCl+HClO 平衡向右移动 , HClO 浓度增大
(2分)
(2)Ca(HCO3)2( 写名称正确同样得分 ) (1分)
(3)2HClO 2HCl +O2↑
(2分)
2HCl +O2↑
(2分)
(4)在导管末端再连接长导管 , 使导管的出口接近量筒底部或换成热水亦可(2分)
【解析】(1)由于次氯酸的酸性弱于碳酸的,但强于HCO3-的酸性,因此碳酸钙只与盐酸反应,而与氯水中的次氯酸是不反应的。即CaCO3 消耗了氯水中的 HCl, 使 Cl2+H2O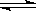 HCl+HClO 平衡向右移动 , HClO 浓度增大,所以漂白性增强。
HCl+HClO 平衡向右移动 , HClO 浓度增大,所以漂白性增强。
(2)第一份与石灰水混合,立即产生大量白色沉淀,白色沉淀应该是碳酸钙,所以反应中还生成了碳酸氢钙,化学式是Ca(HCO3)2。
(3)次氯酸是不稳定的,受热易分解,生成氧气和氯化氢,反应的方程式是2HClO 2HCl +O2↑。
2HCl +O2↑。
(4)由于气体的溶解度随温度的升高而降低,所以要降低CO2的溶解,则可以将水换成热水,或者在导管末端再连接长导管 , 使导管的出口接近量筒底部来减少CO2的溶解。

 阅读快车系列答案
阅读快车系列答案
 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某化学实验小组先制取氯气,后将其溶于水制成饱和氯水,并进行了如下定性研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某化学实验小组先制取氯气,后将其溶于水制成饱和氯水,并进行了如下定性研究: 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.2005年的《化学教育》报道了如下实验研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.2005年的《化学教育》报道了如下实验研究: HCl+HClO平衡向右移动,HClO浓度增大
HCl+HClO平衡向右移动,HClO浓度增大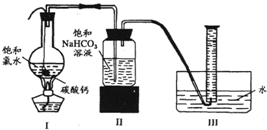
 (1)向蓝色石蕊试纸上滴加几滴饱和氯水,发现试纸先变红后变白.要确证使石蕊褪色的物质是次氯酸,还必须要做的实验是
(1)向蓝色石蕊试纸上滴加几滴饱和氯水,发现试纸先变红后变白.要确证使石蕊褪色的物质是次氯酸,还必须要做的实验是 H++C1-+HClO.反应后所得的溶液漂白性增强的原因是
(用化学平衡移动原理解释)。
H++C1-+HClO.反应后所得的溶液漂白性增强的原因是
(用化学平衡移动原理解释)。