题目内容
【题目】下列氧化还原反应中,电子转移的方向和数目均正确的是( )
A.
B.
C.
D.
【答案】A
【解析】
A. Mg与氧气反应,Mg失电子,氧气得电子,转移电子数为4;
B.反应中Cl元素化合价降低得电子,氧元素化合价升高失电子,转移电子数为12;
C. 氧化还原反应中得失电子数应该相等;
D. CuO与C反应中,铜得电子,C失电子。
A. Mg与氧气反应,Mg失电子,氧气得电子,转移电子数为4,则电子转移的方向和数目为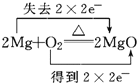 ,A项正确;
,A项正确;
B. 该反应中Cl元素化合价降低得电子,氧元素化合价升高失电子,转移电子数为12,则电子转移的方向和数目为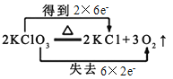 ,B项错误;
,B项错误;
C. 氧化还原反应中得失电子数应该相等,则碳与氧气反应时,电子转移的方向和数目为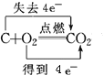 ,C项错误;
,C项错误;
D. CuO与C反应,铜得电子,C失电子,则电子转移的方向和数目为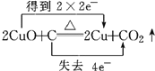 ,D项错误;
,D项错误;
答案选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示,其总反应的化学方程式为_________。

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和n molH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= ![]() ]的关系如图所示。
]的关系如图所示。

①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_______ molL-1·min-1。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下图。(丙烯的结构简式:CH3CH=CH2)

①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。



