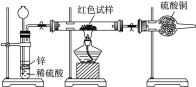
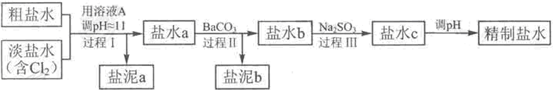
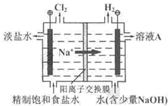
题目内容
下列物质:①Cl2 ②Na ③Na2O2 ④F2分别与水反应,氧化剂与还原剂的物质的量之比为1:1的是( )
| A.①②③ | B.②③④ | C.①②④ | D.①②③④ |
①Cl2+H2O=HCl+HClO中,氯元素的化合价由0价变为-1价和+1价,所以氧化剂和还原剂都是氯气,每个氯原子得电子或失电子个数相等,所以氧化剂和还原剂的物质的量之比为1:1,故正确;
②2Na+2H2O=2NaOH+H2↑,该反应中钠是还原剂,水是氧化剂,氧化剂和还原剂的物质的量之比为1:1,故正确;
③2Na2O2+2H2O=4NaOH+O2↑,该反应中氧元素的化合价由-1价变为0价和-2价,所以过氧化钠既是氧化剂又是还原剂,每个过氧化钠化学式中氧原子得失数相等,所以氧化剂和还原剂的物质的量之比为1:1,故正确;
④2F2+2H2O=4HF+O2,该反应中氟元素的化合价由0价变为-1价,氧元素的化合价由-2价变为0价,所以氟气是氧化剂,水是还原剂,根据方程式知,氧化剂和还原剂的物质的量之比为1:1,故正确;
故选D.
②2Na+2H2O=2NaOH+H2↑,该反应中钠是还原剂,水是氧化剂,氧化剂和还原剂的物质的量之比为1:1,故正确;
③2Na2O2+2H2O=4NaOH+O2↑,该反应中氧元素的化合价由-1价变为0价和-2价,所以过氧化钠既是氧化剂又是还原剂,每个过氧化钠化学式中氧原子得失数相等,所以氧化剂和还原剂的物质的量之比为1:1,故正确;
④2F2+2H2O=4HF+O2,该反应中氟元素的化合价由0价变为-1价,氧元素的化合价由-2价变为0价,所以氟气是氧化剂,水是还原剂,根据方程式知,氧化剂和还原剂的物质的量之比为1:1,故正确;
故选D.

练习册系列答案
相关题目