题目内容
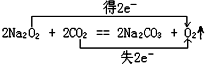
Na2O2常作为供氧剂,发生的主要反应为:2Na2O2+2CO2=2Na2CO3+O2,某次潜水活动若需氧气2.5mol,则至少需要携带多少克过氧化钠?该反应中转移电子的物质的量是多少?
反应2Na2O2+2CO2=2Na2CO3+O2中,只有O元素的化合价发生变化,Na2O2既是氧化剂又是还原剂,O元素化合价分别由-1价升高为0价、降低为-2价,则生成1molO2,转移2mol电子,由方程式可知,某次潜水活动若需氧气2.5mol,需要5mol过氧化钠,质量为5mol×78g/mol=390g,
该反应中转移电子的物质的量是2.5mol×2=5mol,
答:至少需要携带390克过氧化钠,该反应中转移电子的物质的量是5mol.
该反应中转移电子的物质的量是2.5mol×2=5mol,
答:至少需要携带390克过氧化钠,该反应中转移电子的物质的量是5mol.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目


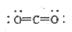
 C6H12O
C6H12O 6+6O2,该变化中光能直接转变为化学能
6+6O2,该变化中光能直接转变为化学能 2CO(g)
2CO(g)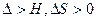 ,该反应常湿下能自发进行
,该反应常湿下能自发进行