题目内容
【题目】①Cu丝 ②Cl2 ③Al2(SO4)3溶液 ④蔗糖 ⑤浓硝酸⑥Ca(OH)2⑦NH4Cl⑧CO2 ⑨氨水
请用以上相应的数字编号和化学用语回答问题:
(1)属于电解质的是__________;属于非电解质的是__________.
(2)实验室制取氨气的化学反应方程式_______________________.
(3)工业制漂白粉的化学反应方程式__________________________.
(4)实验室制Al(OH)3的离子方程式______________________________________________________
(5)①和⑤的化学方程式并用双线桥标出电子转移__________.
【答案】⑥⑦ ④⑧ 2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑+ 2H2O 2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+
CaCl2 + 2NH3↑+ 2H2O 2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+ 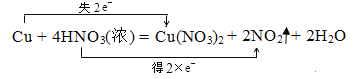
【解析】
(1)根据电解质与非电解质的定义判断。电解质:在水溶液中或熔融状态下能够导电的化合物;非电解质:在熔融状态和水溶液中都不能导电的化合物;单质和混合物既不是单质,也不是非电解质。
(2)实验室用固体氢氧化钙与氯化铵制备氨气;
(3)工业上用氯气与石灰乳(溶质为氢氧化钙)制备漂白粉;
(4)实验室利用硫酸铝与氨水制备Al(OH)3沉淀;
(5)①和⑤反应会生成硝酸铜、二氧化氮与水,根据氧化还原反应的规律,按“标价态”——“连双线”——“注得失”的顺序标出电子得失情况。
①Cu丝为单质,既不是电解质,也不是非电解质;
②Cl2为单质,既不是电解质,也不是非电解质;
③Al2(SO4)3溶液为混合物,既不是电解质,也不是非电解质;
④蔗糖为有机物,在水溶液和熔融状态下不导电,故蔗糖为非电解质;
⑤浓硝酸为浓度较高的硝酸的水溶液,是混合物,故浓硝酸既不是电解质,也不是非电解质;
⑥Ca(OH)2是化合物,溶于水或熔融状态下均会电离出自由移动的离子,则Ca(OH)2是电解质;
⑦NH4Cl在水溶液中能电离出自由移动的铵根离子和氯离子,则NH4Cl是电解质;
⑧CO2为化合物,溶于水后形成碳酸,但自身不能电离出自由移动的离子,故CO2为非电解质;
⑨氨水为一水合氨的水溶液,为混合物,故氨水既不是电解质,也不是非电解质;
故属于电解质的为:⑥⑦;非电解质的为:④⑧,
答案为:⑥⑦;④⑧;
(2)实验室制取氨气的化学反应方程式:2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑+ 2H2O,
CaCl2 + 2NH3↑+ 2H2O,
故答案为:2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+ 2H2O;
CaCl2 + 2NH3↑+ 2H2O;
(3)工业上用氯气与氢氧化钙反应制取漂白粉,其化学方程式为:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O,
故答案为:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O;
(4)实验室利用硫酸铝与氨水反应制取Al(OH)3,其离子方程式为:Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+,
故答案为:Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+;
(5)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,用双线桥法表示电子转移数目如下:
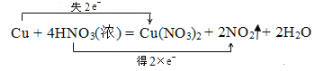 ,
,
故答案为: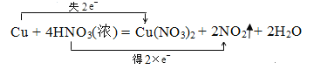 。
。