题目内容
现有A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,已知A、D位于同一主族,A元素在元素周期表中原子半径最小,C是非金属性最强的元素,B、E原子最外层电子数相等,且B、E原子序数之和是A、D原子序数之和的两倍,F的最高价氧化物对应的水化物酸性最强.
(1)请在如图塔式元素周期表(元素周期表的另一种画法)相应位置中标出B元素的元素符号,同时在图中将过渡元素涂黑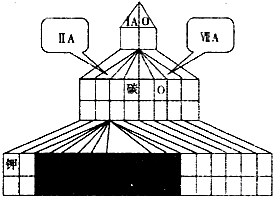
 .
.
(2)D元素的简单离子的离子结构示意图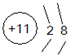
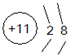
(3)B、E形成的气态氢化物的熔沸点那个高
(4)E与C或F均能形成一些化合物,据有关资料E与C能形成化合物EC6,E能与F能形成化合物E2F2.请回答下面问题:
①甲同学通过分析认为EC6此物质不可能在O2中燃烧,原因是:
②乙同学通过查资料知化合物E2F2中既存在极性键,又存在非极性键,试写出其电子式:
 ;该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液.试写出该过程的反应方程式
;该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液.试写出该过程的反应方程式
(1)请在如图塔式元素周期表(元素周期表的另一种画法)相应位置中标出B元素的元素符号,同时在图中将过渡元素涂黑


(2)D元素的简单离子的离子结构示意图
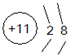
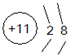
(3)B、E形成的气态氢化物的熔沸点那个高
H2O
H2O
,(用具体的化学式表示).(4)E与C或F均能形成一些化合物,据有关资料E与C能形成化合物EC6,E能与F能形成化合物E2F2.请回答下面问题:
①甲同学通过分析认为EC6此物质不可能在O2中燃烧,原因是:
硫在SF6中显+6价不可再升,O2不可将负一价氟氧化
硫在SF6中显+6价不可再升,O2不可将负一价氟氧化
,②乙同学通过查资料知化合物E2F2中既存在极性键,又存在非极性键,试写出其电子式:


2S2Cl2+2H2O=4HCl+SO2↑+3S↓
2S2Cl2+2H2O=4HCl+SO2↑+3S↓
.分析:A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,A元素在元素周期表中原子半径最小,则A为H;C是非金属性最强的元素,则C为F;A、D位于同一主族,则D为Na;B、E原子最外层电子数相等,且B、E原子序数之和是A、D原子序数之和的两倍,则B为O,E为S;F的最高价氧化物对应的水化物酸性最强,则F为Cl,然后利用元素及其单质、化合物的性质来解答.
解答:解:A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,A元素在元素周期表中原子半径最小,则A为H;C是非金属性最强的元素,则C为F;A、D位于同一主族,则D为Na;B、E原子最外层电子数相等,且B、E原子序数之和是A、D原子序数之和的两倍,则B为O,E为S;F的最高价氧化物对应的水化物酸性最强,则F为Cl,
(1)B为O,在元素周期表中的第二周期第ⅥA族,从第四周期开始出现过渡元素,共10列,如图为 ,
,
故答案为: ;
;
(2)D为钠,质子数为11,易失去1个电子,离子结构示意图为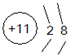 ,故答案为:
,故答案为: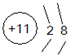 ;
;
(3)水中含氢键,则H2O的沸点比H2S的沸点高,故答案为:H2O;
(4)①燃烧反应中,氧气作氧化剂,而硫在SF6中显+6价不可再升,O2不可将负一价氟氧化,则SF6不可能在O2中燃烧,
故答案为:硫在SF6中显+6价不可再升,O2不可将负一价氟氧化;
②S2Cl2中既存在极性键,又存在非极性键,则电子式为 ,S2Cl2遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液,由质量守恒定律可知该反应为
,S2Cl2遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液,由质量守恒定律可知该反应为
2S2Cl2+2H2O=4HCl+SO2↑+3S↓,故答案为: ;2S2Cl2+2H2O=4HCl+SO2↑+3S↓.
;2S2Cl2+2H2O=4HCl+SO2↑+3S↓.
(1)B为O,在元素周期表中的第二周期第ⅥA族,从第四周期开始出现过渡元素,共10列,如图为
 ,
,故答案为:
 ;
;(2)D为钠,质子数为11,易失去1个电子,离子结构示意图为
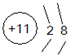 ,故答案为:
,故答案为: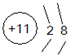 ;
;(3)水中含氢键,则H2O的沸点比H2S的沸点高,故答案为:H2O;
(4)①燃烧反应中,氧气作氧化剂,而硫在SF6中显+6价不可再升,O2不可将负一价氟氧化,则SF6不可能在O2中燃烧,
故答案为:硫在SF6中显+6价不可再升,O2不可将负一价氟氧化;
②S2Cl2中既存在极性键,又存在非极性键,则电子式为
 ,S2Cl2遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液,由质量守恒定律可知该反应为
,S2Cl2遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液,由质量守恒定律可知该反应为2S2Cl2+2H2O=4HCl+SO2↑+3S↓,故答案为:
 ;2S2Cl2+2H2O=4HCl+SO2↑+3S↓.
;2S2Cl2+2H2O=4HCl+SO2↑+3S↓.点评:本题考查原子结构与元素周期律,注重对学生知识的迁移能力的考查,(4)是学生分析和解答的难点,注意利用氧化还原反应及质量守恒定律来分析.

练习册系列答案
相关题目
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.






